
Wetenschap
Welk bewijs is er dat de karakteristieke kleur die voor elke verbinding wordt waargenomen vanwege metaalion in het geval dat?
1. D-orbitale splitsing:
* overgangsmetalen: Overgangsmetalen hebben gedeeltelijk gevulde D-orbitalen. Deze D-orbitalen zijn gedegenereerd (hebben hetzelfde energieniveau) in een geïsoleerd atoom.
* Ligand Field: Wanneer een overgangsmetaalion wordt omgeven door liganden (ionen of moleculen die aan het metaal binden), veroorzaakt het elektrische veld van de liganden een splitsing van deze gedegenereerde D-orbitalen in verschillende energieniveaus. De omvang van deze splitsing hangt af van de aard van de liganden en het metaalion.
2. Elektronische overgangen:
* Absorptie van licht: Wanneer een verbinding licht absorbeert, kan een elektron in een lagere energie D-orbitaal worden opgewonden tot een hogere energie-orbitaal. Het energieverschil tussen deze orbitalen komt overeen met een specifieke golflengte van licht.
* kleurperceptie: De kleur die we waarnemen is de complementaire kleur van het geabsorbeerde licht. Als een verbinding bijvoorbeeld blauw licht absorbeert, zien we de complementaire kleur, oranje.
bewijs:
* Spectroscopische studies: UV-VIS-spectroscopie bevestigt de absorptie van specifieke golflengten van licht door overgangsmetaalverbindingen, die direct de D-orbitale splitsingstheorie ondersteunen.
* kleurverandering met liganden: Het veranderen van de liganden die een metaalion omringen, leidt vaak tot een verandering in kleur, vanwege veranderde D-orbitale splitsing en verschillende golflengten van geabsorbeerd licht. Dit is de reden waarom verschillende coördinatiecomplexen van hetzelfde metaal verschillende kleuren kunnen hebben.
* kleurvariatie binnen een metalen serie: Overgangsmetalen in dezelfde serie (bijv. Chroom, mangaan, ijzer) vertonen vaak een trend in kleur, die veranderingen in het aantal D-elektronen en de daaruit voortvloeiende D-orbitale splitsingspatronen weerspiegelt.
Voorbeelden:
* koper (II) ionen: Typisch blauw of groen, vanwege D-D-overgangen in het Cu (II) -ioncomplex.
* kobalt (ii) ionen: Kan roze, rood of blauw zijn, afhankelijk van de liganden, opnieuw toegeschreven aan D-D-overgangen.
* nikkel (ii) ionen: Vaak groen, maar kunnen andere kleuren zijn, afhankelijk van de liganden, opnieuw vanwege D-D-overgangen.
Samenvatting:
De karakteristieke kleur van een verbinding die een overgangsmetaalion bevat, is het gevolg van de unieke energieniveausplitsing van de D-orbitalen veroorzaakt door de liganden en de daaropvolgende elektronische overgangen die optreden wanneer licht wordt geabsorbeerd. Dit fenomeen wordt ondersteund door spectroscopische studies en de waargenomen kleurveranderingen op basis van liganden en metaalionvariatie.
 COVID-19:Aeolus en weersvoorspellingen
COVID-19:Aeolus en weersvoorspellingen Drones geven in vogelvlucht weer hoe turbulente getijdenstromen de foerageergewoonten van zeevogels beïnvloeden
Drones geven in vogelvlucht weer hoe turbulente getijdenstromen de foerageergewoonten van zeevogels beïnvloeden  Wat betekent het woord licht in de wetenschap?
Wat betekent het woord licht in de wetenschap?  Geradicaliseerd en gelovend in complotten:kan de cyclus doorbroken worden?
Geradicaliseerd en gelovend in complotten:kan de cyclus doorbroken worden?  Milieustudies ondersteunen Trumps schoonste bewering niet
Milieustudies ondersteunen Trumps schoonste bewering niet
Hoofdlijnen
- Oorzaken van Cytoplasmic Streaming
- Waar werken lipase op?
- Welk stadium mitose is het wanneer chromosomen verkorten en dikker worden, begint het nucleaire membraan te verdwijnen?
- Wat betekent het plant verspreiding?
- Wat is een manier waarop cnidarians en weekdieren verschillen?
- Hoe verschillen nostoccellen van Streptococcus -bacteriecellen?
- Onderzoeken hoe bryofyten zich aanpassen zonder gibberelline
- Waarom bestaan antigenen uit eiwitten?
- Wat zijn de enzymen in Siliva?
- Dubbellaagse katalysator genereert meer waterstof
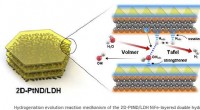
- Schone waterstof maken is moeilijk, maar onderzoekers hebben zojuist een grote hindernis opgelost

- Een verademing voor batterijen die langer meegaan
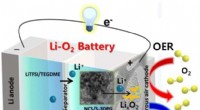
- Op weg naar een betere batterij:wetenschappers ontdekken de bron van degradatie in natriumbatterijen
- Sterk en kneedbaar Damascus-staal door additieve fabricage

 Nanotech-filter scheidt olie en water
Nanotech-filter scheidt olie en water Is Moss een lid van het Fungi -koninkrijk?
Is Moss een lid van het Fungi -koninkrijk?  Welk type materiaal gaat er geen elektronen uit om er gemakkelijk doorheen te stromen?
Welk type materiaal gaat er geen elektronen uit om er gemakkelijk doorheen te stromen?  Hoe te controleren op redelijkheid in vermenigvuldiging
Hoe te controleren op redelijkheid in vermenigvuldiging  Wat zijn combinatie van fundamentele eenheden die worden genoemd?
Wat zijn combinatie van fundamentele eenheden die worden genoemd?  Wat is een apparaatwinkel en produceert elektrische energie?
Wat is een apparaatwinkel en produceert elektrische energie?  Welke heeft polaire covalente bindingen Cl2 Cao N2 of SO2?
Welke heeft polaire covalente bindingen Cl2 Cao N2 of SO2?  Nanoshuttle-slijtage:het is de kilometerstand, niet de leeftijd
Nanoshuttle-slijtage:het is de kilometerstand, niet de leeftijd
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

