
Wetenschap
Wat gebeurt er met de kookpunten van koolwaterstoffen naarmate ze groter worden?
* van der Waals krachten: Grotere koolwaterstoffen hebben meer elektronen, wat leidt tot sterkere dispersiekrachten in Londen (een type van der Waals Force). Deze krachten komen voort uit tijdelijke schommelingen in elektronenverdeling, waardoor tijdelijke dipolen ontstaan die elkaar aantrekken.
* oppervlakte: Grotere koolwaterstoffen hebben een groter oppervlak voor deze intermoleculaire krachten om op te werken.
* Meer energie vereist: Om deze sterkere intermoleculaire krachten te breken, is meer energie (in de vorm van warmte) nodig om ze te overwinnen en het kookpunt te bereiken.
Samenvattend: Naarmate koolwaterstofmoleculen in grootte toenemen, vereisen de sterkere van der Waals -krachten meer energie om te overwinnen, wat resulteert in hogere kookpunten.
 5, 000 Dieselgate-sterfgevallen in Europa per jaar:studie
5, 000 Dieselgate-sterfgevallen in Europa per jaar:studie Voorgeschreven brandweerlieden hebben nieuwe tools binnen handbereik
Voorgeschreven brandweerlieden hebben nieuwe tools binnen handbereik Zijn niet -vasculaire planten beter geschikt voor het leven op het land?
Zijn niet -vasculaire planten beter geschikt voor het leven op het land?  Hoe worden planten aangepast aan zandduinomgeving?
Hoe worden planten aangepast aan zandduinomgeving?  Wie bestudeert processen die in de aarde veranderen?
Wie bestudeert processen die in de aarde veranderen?
Hoofdlijnen
- Waarom is geen cellulaire energie vereist om het passagiersmolecuul door dragermolecuul over celmembraan te dragen?
- Engels domineert wetenschappelijk onderzoek. Hier leest u hoe we dit kunnen oplossen en waarom het ertoe doet
- Wat is de functie van ATP-PC of CP?
- Laat je huisdier niet per ongeluk dronken worden dit gekke seizoen (sorry Tiddles)
- Zon, zee, duurzaamheid:zou je volgende Europese vakantie een groenere kunnen zijn?
- Verbetering van de detectie van antilichamen tegen het Afrikaanse varkenspestvirus in serum
- Nieuw onderzoek laat zien hoe virussen 'goede' darmbacteriën gebruiken om het immuunsysteem te omzeilen
- Welke radioactieve tracer verscheen in de bacteriën die Hershey leidden en achtervolgde tot hun conclusie DNA niet eiwit was genetisch materiaal?
- Wat is hypothyreoïdie?
- Dit molecuul is gemaakt van suiker, in de vorm van een donut, en gevormd met behulp van licht
- Een nieuwe wiskundige benadering om zeolieten te begrijpen
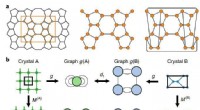
- De nieuwste:Nobelprijswinnaar zoals Google Earth voor moleculen

- Waarom een nieuwsgierige schaaldier het geheim zou kunnen houden om hernieuwbare energie uit hout te maken

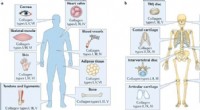
- Onderzoekers kwantificeren, karakteriseren en identificeren functies van collageen, zijn subtypes
 Hoe beweegt de zon rond de aarde?
Hoe beweegt de zon rond de aarde?  Hoe cellulaire vingertoppen cellen kunnen helpen met elkaar te ‘praten’
Hoe cellulaire vingertoppen cellen kunnen helpen met elkaar te ‘praten’  Welke organelfunctie in eukaryotische cellulaire ademhaling waarin ATP wordt geproduceerd?
Welke organelfunctie in eukaryotische cellulaire ademhaling waarin ATP wordt geproduceerd?  Antikankermechanisme onthuld in gistexperimenten
Antikankermechanisme onthuld in gistexperimenten In twee staten, legalisatie van recreatieve marihuana blijkt weinig effect te hebben op criminaliteit
In twee staten, legalisatie van recreatieve marihuana blijkt weinig effect te hebben op criminaliteit Team ontwikkelt nieuw proces voor het maken van SWCNT-films
Team ontwikkelt nieuw proces voor het maken van SWCNT-films Welke eigenschap is de beste indicator dat een verbinding ionisch kan zijn?
Welke eigenschap is de beste indicator dat een verbinding ionisch kan zijn?  De kristalstructuur laat zien hoe motoreiwit werkt
De kristalstructuur laat zien hoe motoreiwit werkt
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

