
Wetenschap
Leg uit waarom de koolstofchloorbinding fotodissociates en fluor niet doen?
1. Bindingssterkte:
* C-Cl-binding: De C-CL-binding is zwakker dan de C-F-binding vanwege de grotere omvang chloor in vergelijking met fluor. Dit betekent dat er minder energie nodig is om de C-Cl-binding te verbreken.
* C-F binding: De C-F-binding is zeer sterk vanwege de kleine omvang en de hoge elektronegativiteit van fluor, waardoor het moeilijker is om te breken.
2. Energie van invallende licht:
* UV -licht: Fotodissociatie treedt meestal op wanneer moleculen worden blootgesteld aan ultraviolet (UV) licht. De energie van UV-fotonen is voldoende om de zwakkere C-Cl-binding te verbreken.
* Hoger energielampje: Het verbreken van de sterkere C-F-binding vereist nog hogere energiefotonen, vaak in het verre UV- of röntgenbereik, die minder gebruikelijk zijn in typische omgevingen.
Samenvattend:
* C-Cl-binding: De relatief zwakke binding en de energie van UV -licht zijn voldoende om fotodissociatie te veroorzaken.
* C-F binding: De sterke binding vereist een hoger energielicht om te breken, wat minder direct beschikbaar is, waardoor fotodissociatie minder waarschijnlijk is.
Voorbeeld:
Chlorofluorocarbons (CFC's) staan bekend om hun vermogen om de ozonlaag uit te putten door fotodissociatie. Bij blootstelling aan UV-licht breekt de C-CL-binding in CFC's en brengt chlooratomen vrij die de vernietiging van ozonmoleculen katalyseren. De C-F-bindingen in deze moleculen blijven echter intact, wat bijdraagt aan de stabiliteit van CFC's.
Concluderend komen het verschillende fotodissociatiegedrag van C-Cl en C-F-bindingen voort uit hun contrasterende bindingssterkten en de energie die nodig is om ze te breken. Dit verschil in bindingssterkte is cruciaal voor het begrijpen van de milieu -implicaties van deze moleculen.
 West-Afrika warmt op, maar stof in de lucht houdt de Rode Zee koel
West-Afrika warmt op, maar stof in de lucht houdt de Rode Zee koel Instortingen van de flank van een groot vulkanisch eiland leiden tot catastrofale uitbarstingen
Instortingen van de flank van een groot vulkanisch eiland leiden tot catastrofale uitbarstingen Antarctische ijskap kan een een-tweetje krijgen
Antarctische ijskap kan een een-tweetje krijgen Waarom jeneverbesbomen met minder water kunnen leven
Waarom jeneverbesbomen met minder water kunnen leven  Hoe de hersengrootte de jachtstrategie in de insectenwereld beïnvloedt
Hoe de hersengrootte de jachtstrategie in de insectenwereld beïnvloedt
Hoofdlijnen
- Wat zijn functies van mitose die kinderen kunnen weten?
- Hoe is DNA geordend om in een cel te passen?
- Wat doen de rhizoïden van bryophytes?
- Wat is splitsing in anatomie?
- Hoe wordt het proces genoemd wanneer een cel zich in 2 delen verdeelt, dan 4 delen?
- Wat doet een luchtpijpcel?
- Maak een lijst van de stappen van de celcyclus in volgorde
- Verbetering van de hittetolerantie in graszoden in het koele seizoen
- Waarom restaurants willen dat je eten bestelt op je telefoon
- Schorpioenen maken een fluorescerende stof die hen kan helpen beschermen tegen parasieten

- Tumbleweeds of fibrillen:Tau-eiwitten moeten kiezen
- Wat als we krachtige medicijnen zouden kunnen ontwerpen zonder ongewenste bijwerkingen?

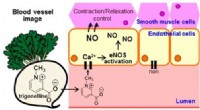
- Verbindingen in monsterradijs kunnen hart- en vaatziekten helpen temmen
- Onderzoekers ontwikkelen een rekrek voor cellen

 Wetenschapsprojecten: een skelet maken
Wetenschapsprojecten: een skelet maken  Wat is de massa van 1,5E23-watermoleculen?
Wat is de massa van 1,5E23-watermoleculen?  Onderzoekers die werken aan het detecteren, tornado's volgen
Onderzoekers die werken aan het detecteren, tornado's volgen 72% van de Australiërs is seksueel lastiggevallen, en het systeem om het probleem op te lossen is kapot
72% van de Australiërs is seksueel lastiggevallen, en het systeem om het probleem op te lossen is kapot Wat is de eerste stap van het maken van geothermische energie?
Wat is de eerste stap van het maken van geothermische energie?  Wat is natuurlijke vormen?
Wat is natuurlijke vormen?  Wat betekent wrijving in de wetenschap?
Wat betekent wrijving in de wetenschap?  Hoe extreemrechtse onlineruimtes de reguliere media gebruiken om hun ideologie te verspreiden
Hoe extreemrechtse onlineruimtes de reguliere media gebruiken om hun ideologie te verspreiden
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

