
Wetenschap
Hoe werkt de chemische reactie?
Hoe chemische reacties werken:een vereenvoudigde uitleg
Stel je een chemische reactie voor als een spel van bouwstenen. Elk blok vertegenwoordigt een atoom, de kleinste eenheid van een element. Verschillende soorten blokken hebben verschillende vormen en eigenschappen. Wanneer blokken botsen, kunnen ze zichzelf herschikken om nieuwe structuren te vormen - moleculen.
Hier is een uitsplitsing:
1. Reactanten: Dit zijn de startmaterialen van de reactie. Stel je twee verschillende soorten blokken voor, "A" en "B".
2. Botsing: Om een reactie te laten gebeuren, moeten de "A" en "B" -blokken botsen met voldoende energie om hun bestaande bindingen te verbreken. Deze energie wordt activeringsenergie genoemd .
3. Bond breken en vormen: De botsing veroorzaakt bindingen tussen de atomen in de reactanten om te breken. Nieuwe bindingen vormen zich vervolgens tussen de atomen en herschikken ze in nieuwe structuren.
4. Producten: Dit zijn de nieuwe stoffen gevormd als gevolg van de reactie. Laten we zeggen dat de herschikte blokken nieuwe structuren vormen, "C" en "D".
Belangrijke factoren die de reacties beïnvloeden:
* Temperatuur: Hogere temperaturen bieden meer energie voor botsingen, waardoor reacties sneller optreden.
* concentratie: Meer reactantmoleculen betekenen meer kansen op botsingen en snellere reacties.
* katalysator: Een katalysator versnelt een reactie zonder te worden geconsumeerd. Het biedt een alternatief pad voor de reactie, waardoor minder activeringsenergie nodig is.
* oppervlakte: Meer oppervlakte van reactanten betekent meer contactpunten voor botsingen, wat leidt tot snellere reacties.
Soorten reacties:
* combinatie: Twee of meer reactanten combineren om een enkel product te vormen (A + B → C).
* Ontleding: Een enkele reactant valt af in twee of meer producten (C → A + B).
* Enkele verplaatsing: Het ene element vervangt het andere in een verbinding (A + BC → AC + B).
* Dubbele verplaatsing: Twee verbindingen uitwisselen ionen (AB + CD → AD + CB).
belangrijke punten om te onthouden:
* Reacties worden beheerst door de wet van behoud van massa , wat betekent dat de totale massa reactanten gelijk is aan de totale massa producten.
* Reacties kunnen omkeerbaar zijn , wat betekent dat producten opnieuw kunnen reageren om opnieuw reactanten te vormen.
* Sommige reacties geven warmte vrij (exotherme), terwijl anderen warmte nodig hebben (Endotherm).
Samenvattend: Chemische reacties omvatten de herschikking van atomen door het breken en vormen van bindingen, aangedreven door botsingen en beïnvloed door verschillende factoren. Het is een fundamenteel proces dat verantwoordelijk is voor alles, van koken tot fotosynthese tot het maken van nieuwe materialen.
Hoofdlijnen
- De meeste exemplaren van schadelijke recessieve allelen worden gedragen?
- Nieuwe technologie verandert de manier waarop eiwitten in individuele cellen worden bestudeerd
- Wat zijn de attributen van levende organismen?
- Hoe je eiwitten op de juiste snelheid produceert
- Organismen met gunstige variatie reproduceren succesvoller dan organismen minder variaties. Deze verklaring beschrijft het beste het concept van?
- Wat gebeurt er met de bacteriën als het wordt gemengd met witte bloedcellen?
- Hoe T-cellen ervoor zorgen dat ze rust hebben
- Onderzoekers kijken naar de fruitvlieg om het menselijk brein te begrijpen
- Wat voor soort cel vormt je lichaam prokaryotisch of eykaryotisch?
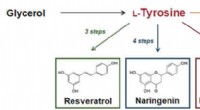
- Tyrosinechassis voor duurzame productie met hoog rendement van nuttige verbindingen in slimme gistcellen
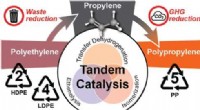
- Wetenschappers ontdekken het upcyclen van plastic om de uitstoot van broeikasgassen te verminderen
- Kevers zorgen voor ontwikkeling van kleurveranderende nanodeeltjes voor commercieel gebruik

- Wetenschappers kweken snel een DKDP-kristal met lange zaden

- Licht werpen op een schimmige organisatorische hub in cellen
 Krijg grip! Bruisend nieuw bewijsmateriaal over waarom we vingerafdrukken hebben
Krijg grip! Bruisend nieuw bewijsmateriaal over waarom we vingerafdrukken hebben  Wat is een vast mengsel in de klas?
Wat is een vast mengsel in de klas?  Hoeveel helderder is een volle maan dan halve maan?
Hoeveel helderder is een volle maan dan halve maan?  Winst van Tencent stijgt als het uit het moeras van gaming komt
Winst van Tencent stijgt als het uit het moeras van gaming komt Natuurlijk molecuul om de prestaties van elektroden voor oplaadbare batterijen te verbeteren
Natuurlijk molecuul om de prestaties van elektroden voor oplaadbare batterijen te verbeteren Wat zei Isaac Newton over het atoom?
Wat zei Isaac Newton over het atoom?  Wat zou meestal door geoloog worden bestudeerd?
Wat zou meestal door geoloog worden bestudeerd?  Verklaar de zwaartekracht tussen twee objecten?
Verklaar de zwaartekracht tussen twee objecten?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


