
Wetenschap
Hoe ziet het shell -model eruit voor kaliumchloride?
Inzicht in de basis
* ionische binding: Kaliumchloride vormt zich door ionische binding, waarbij kalium (k) een elektron verliest om een positief geladen ion (k+) en chloor (CL) te worden, krijgt een elektron om een negatief geladen ion te worden (cl-).
* elektronenschalen: Elektronen in atomen bezetten specifieke energieniveaus die schelpen worden genoemd. Elke schaal kan een maximaal aantal elektronen bevatten.
Shell -model van kalium (K)
1. Shell 1: Bevat 2 elektronen (gevuld).
2. Shell 2: Bevat 8 elektronen (gevuld).
3. Shell 3: Bevat 8 elektronen (gevuld).
4. Shell 4: Bevat 1 elektron (dit elektron gaat gemakkelijk verloren).
Shell -model van chloor (CL)
1. Shell 1: Bevat 2 elektronen (gevuld).
2. Shell 2: Bevat 8 elektronen (gevuld).
3. Shell 3: Bevat 7 elektronen (één kort voor gevuld).
hoe ze binden
* k verliest zijn buitenste elektron: Dit laat kalium achter met een volledige buitenste schaal (3e schaal) en een positieve lading.
* CL wint een elektron: Dit vult de buitenste schaal van chloor (3e schaal) en geeft het een negatieve lading.
Het resultaat:
De tegenovergestelde ladingen van de K+ en Climes trekken elkaar sterk aan en vormen een ionische binding.
Visualisatie van het shell -model:
U kunt het shell -model vertegenwoordigen als concentrische cirkels rond het atoomsymbool. Hier is een eenvoudige manier om het te visualiseren:
* kalium (k):
* 2 elektronen in de binnenste cirkel
* 8 elektronen in de volgende cirkel
* 8 elektronen in de volgende cirkel
* 1 elektron in de buitenste cirkel
* chloor (CL):
* 2 elektronen in de binnenste cirkel
* 8 elektronen in de volgende cirkel
* 7 elektronen in de buitenste cirkel
Na binding zou je K+ en Cl- afbeelden met:
* k+: 2, 8, 8 (volledige buitenste schaal)
* Cl-: 2, 8, 8 (volledige buitenste schaal)
Laat het me weten als je een meer gedetailleerd diagram wilt of nog andere vragen hebt!
 Waarom lost zout anders op in koud water dan in kokend water?
Waarom lost zout anders op in koud water dan in kokend water?  Hoe beïnvloedt azijn smelten ijs?
Hoe beïnvloedt azijn smelten ijs?  NH4OH is onstabiel in wateroplossing dat het ontleedt om H2O NH3 een vergelijking te geven voor de reactie van ammoniumfosfaat met lithiumhydroxide?
NH4OH is onstabiel in wateroplossing dat het ontleedt om H2O NH3 een vergelijking te geven voor de reactie van ammoniumfosfaat met lithiumhydroxide?  In een veld waar kleiner beter is, onderzoekers ontdekken 's werelds kleinste antistoffen
In een veld waar kleiner beter is, onderzoekers ontdekken 's werelds kleinste antistoffen Wat heeft een grotere kookpuntverhoging als het wordt opgelost in een concentratie van 1 mol in water met NaCl of MgCl2?
Wat heeft een grotere kookpuntverhoging als het wordt opgelost in een concentratie van 1 mol in water met NaCl of MgCl2?
 Versnelde uitspoeling van radiocesium uit strooisel op de bosbodem door hevige regenval
Versnelde uitspoeling van radiocesium uit strooisel op de bosbodem door hevige regenval Welke overheidsinstantie heeft een fysieke wetenschapper in dienst en probeert te begrijpen dat de aardomgeving beschermen?
Welke overheidsinstantie heeft een fysieke wetenschapper in dienst en probeert te begrijpen dat de aardomgeving beschermen?  Hoeveel uren van het daglicht in de zomer?
Hoeveel uren van het daglicht in de zomer?  Een krachtig koufront:waarom Australië kijkt naar een week met zwaar koud weer
Een krachtig koufront:waarom Australië kijkt naar een week met zwaar koud weer Afbeelding:Woestijngroen
Afbeelding:Woestijngroen
Hoofdlijnen
- Bevat een skeletspiervezel veel kernen?
- Waarom vereist evolutie diversiteit binnen een soort?
- Wat is de vergelijking cellulaire ademhaling?
- Elke cel is gespecialiseerd om een relatief beperkt bereik van functies uit te voeren via het proces van?
- Wat zijn de 4 hoofdonderdelen van een virus?
- Onderzoeker zegt:No-till-praktijken laten uitgebreide voordelen zien voor tarwe en veevoer
- Is Latijn de taal die het meest wordt gebruikt in de wetenschap?
- Nieuwe mechanismen beschrijven hoe het genoom zichzelf reguleert
- Simpelere tijden:was een eerder genetisch molecuul ouder dan DNA en RNA?
- Door elektriciteit aangedreven onderzeese reacties kunnen belangrijk zijn geweest voor het ontstaan van leven

- Nieuwe bioink brengt 3D-printen van menselijke organen dichter bij de realiteit
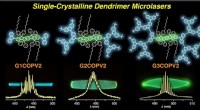
- Dendrimers hebben eindelijk wat nodig is om door te breken in de laserscene
- Smartphone-sensoren kunnen cannabishigh detecteren en hebben de potentie om vroegtijdig in te grijpen

- Vers houden:nieuwe op AI gebaseerde strategie kan de versheid van rundvleesmonsters beoordelen

 Is de prooi aan het einde van de voedselketen?
Is de prooi aan het einde van de voedselketen?  Wat is een legende over Science Fair -project?
Wat is een legende over Science Fair -project?  Wazige beeldlimieten verduidelijkt dankzij informatietechnologie
Wazige beeldlimieten verduidelijkt dankzij informatietechnologie Hoe werken massa en volume samen?
Hoe werken massa en volume samen?  Hoe zijn planeten een sterren anders?
Hoe zijn planeten een sterren anders?  Multitasken als nucleaire non-proliferatie op het spel staat?
Multitasken als nucleaire non-proliferatie op het spel staat? Welke heeft een grotere dichtheid:1 kg platina of 3 kg goud?
Welke heeft een grotere dichtheid:1 kg platina of 3 kg goud?  Energie die door land en water wordt opgenomen, omgezet in?
Energie die door land en water wordt opgenomen, omgezet in?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

