
Wetenschap
Waarom aluminium trifluoride heeft een hoog kookpunt dan silicium tetrafluoride wat een gas is?
1. Bindingssterkte:
* alf₃: Aluminium trifluoride vertoont ionische binding . Het elektronegativiteitsverschil tussen aluminium en fluor is groot, wat leidt tot de overdracht van elektronen en sterke elektrostatische attracties tussen de ionen. Deze sterke ionische bindingen vereisen een aanzienlijke hoeveelheid energie om te breken, wat resulteert in een hoog kookpunt.
* sif₄: Silicium tetrluoride vertoont covalent binding . Hoewel de SI-F-binding polair is, is het molecuul in het algemeen tetraëdrisch en heeft een symmetrische verdeling van de elektronendichtheid. Dit betekent dat de dipoolmomenten annuleren, wat leidt tot zwakkere intermoleculaire krachten (van der Waals -krachten) tussen moleculen. Deze zwakkere krachten zijn veel gemakkelijker te overwinnen, wat leidt tot een laag kookpunt.
2. Roosterstructuur:
* alf₃: Aluminium trifluoride vormt een driedimensionaal kristalrooster . Deze sterke, geordende structuur verhoogt verder de energie die nodig is om de vaste stof uit elkaar te breken en te verdampen.
* sif₄: Silicium tetrafluoride is een moleculaire vaste stof met zwakke intermoleculaire krachten die de moleculen bij elkaar houden.
Samenvattend:
* De ionische binding in ALF₃ leidt tot sterke elektrostatische krachten die veel meer energie vereisen om te overwinnen dan de zwakkere Van der Waals -krachten in SIF₄.
* De driedimensionale roosterstructuur in ALF₃ versterkt de bindingen verder en verhoogt de energie die nodig is voor verdamping.
Deze factoren dragen bij aan het significante verschil in kookpunten tussen ALF₃ en SIF₄.
 Orkanen kunnen heviger worden - hebben we een hele nieuwe categorie nodig om ze te beschrijven?
Orkanen kunnen heviger worden - hebben we een hele nieuwe categorie nodig om ze te beschrijven? GPM analyseert regenval in Bahama's van potentiële tropische cycloon
GPM analyseert regenval in Bahama's van potentiële tropische cycloon NASA ogen compacte orkaan Hilary
NASA ogen compacte orkaan Hilary Model simuleert wereldwijde watervoorziening
Model simuleert wereldwijde watervoorziening Waarom is vuur een man gemaakt en een natuurlijke lichtbron?
Waarom is vuur een man gemaakt en een natuurlijke lichtbron?
Hoofdlijnen
- Welke cellen bevinden zich in een plantencel?
- Wat zijn de decomponistische stappen voor schimmels?
- Wat is de functie van de keel?
- Hoe kan obesitas genetisch zijn?
- Op welke drie manieren verspreiden dieren zaden?
- Hoeveel basenparen zijn er in wat als uw genoom?
- Wat is het proces waarmee voedingsmoleculen worden verplaatst naar de bloedbaan die wordt genoemd?
- Wat wordt bedoeld met waargenomen genotypen?
- Deelt een amoeba in een halve vorm van reproductie?
- Doorbraak in halfgeleiders kan game-changer zijn voor organische zonnecellen

- Wetenschappers ontwikkelen een cellulose-biosensormateriaal voor geavanceerde weefseltechnologie
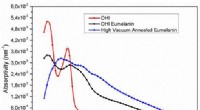
- Zullen cyborgs gemaakt worden van melanine? Pigmentdoorbraak maakt biocompatibele elektronica mogelijk
- Ontwikkeld materiaal dat tegelijkertijd warmte-isolerend en warmtegeleidend is

- Onderzoekers vinden grote lineaire negatieve thermische uitzetting in intermetallische Cr-Se-Te-verbindingen

 Waarom won Frederick Sanger de Nobelprijs in de chemie 1958?
Waarom won Frederick Sanger de Nobelprijs in de chemie 1958?  Wetenschappers onderzoeken hoe meststoffen met langzame afgifte zich in de bodem gedragen
Wetenschappers onderzoeken hoe meststoffen met langzame afgifte zich in de bodem gedragen  At-Home Science: Color Mixing Experiment
At-Home Science: Color Mixing Experiment  Wat stelt het doel van een experiment?
Wat stelt het doel van een experiment?  De zwerm schudden - onderzoekers onderzoeken hoe bijen samenwerken om zwermclusters te stabiliseren
De zwerm schudden - onderzoekers onderzoeken hoe bijen samenwerken om zwermclusters te stabiliseren Vergelijking in de reacties van benzylalcohol en natriummetaal?
Vergelijking in de reacties van benzylalcohol en natriummetaal?  In sediment levende wezens die gevaar lopen door nanodeeltjes in gewone huishoudelijke producten
In sediment levende wezens die gevaar lopen door nanodeeltjes in gewone huishoudelijke producten Hoe cellen 'klimmen' om luchtpijpen van fruitvliegjes te bouwen
Hoe cellen 'klimmen' om luchtpijpen van fruitvliegjes te bouwen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

