
Wetenschap
Waarom vormt benzoëzuur een dimeer in benzeen en geen water?
in benzeen:
* benzeen is een niet-polair oplosmiddel: Het kan geen waterstofbruggen vormen met benzoëzuur.
* Waterstofbinding binnen benzoëzuur: Benzoëzuurmoleculen kunnen sterke waterstofbruggen vormen tussen de carboxylgroep (COOH) van het ene molecuul en de carbonylgroep (C =O) van een ander. Deze intermoleculaire waterstofbinding leidt tot de vorming van dimeren.
* Gunstige interacties: De dimeervorming in benzeen wordt begunstigd omdat het de blootstelling van de polaire carboxylgroep aan de niet-polaire omgeving minimaliseert, wat leidt tot een stabielere configuratie.
in water:
* Water is een polair oplosmiddel: Watermoleculen kunnen sterke waterstofbruggen vormen met de carboxylgroep benzoëzuur.
* concurrentie voor waterstofbinding: De sterke waterstofbinding tussen benzoëzuur en watermoleculen concurreert met de waterstofbinding tussen benzoëzuurmoleculen, waardoor dimeervorming minder gunstig is.
* Gunstige interacties: Benzoëzuurmoleculen geven er de voorkeur aan om te interageren met watermoleculen door waterstofbinding, wat energetisch gunstiger is dan het vormen van dimeren.
Samenvatting:
Het verschil in oplosmiddelpolariteit en het vermogen om waterstofbindingen te vormen leidt tot de vorming van benzoëzuurdimeren in benzeen maar niet in water. De niet-polaire aard van benzeen bevordert dimerisatie, terwijl de polaire aard van water waterstofbinding tussen benzoëzuur en watermoleculen bevordert, waardoor dimeervorming wordt voorkomen.
Hoofdlijnen
- Hoe classificeren wetenschappers planten?
- Onderzoek zou de weg kunnen vrijmaken voor een beter begrip van de manier waarop planten en dieren groeien en zich ontwikkelen
- Welke activiteit vindt plaats in S mitochondria?
- Het voorspellen van migratieroutes van muilezelherten zonder GPS-halsbanden
- Waar remmen cycloheximide eiwitsynthese?
- Wat is de niche van een petrel?
- Dood door duizend sneden? Niet voor kleine populaties
- Oorsprong van het leven:Begon de Darwinistische evolutie vóór het leven zelf?
- Welk woord is Quackenbush dat ervoor zorgt dat Gene vecht?
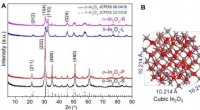
- Efficiënte indiumoxidekatalysatoren ontworpen voor CO2-hydrogenering tot methanol
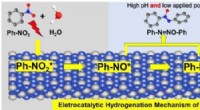
- Hydrogeneringsregeling van nitrobenzeen in elektrokatalytische processen gerealiseerd
- Wanneer meer botvormende cellen gelijk zijn aan minder bot

- Mysterieuze cellulaire druppeltjes komen in beeld
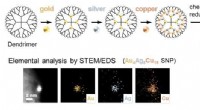
- Sub-nanodeeltjeskatalysatoren gemaakt van muntelementen als effectieve katalysatoren
 Wat zijn de 4 delen in natuurlijke selectie?
Wat zijn de 4 delen in natuurlijke selectie?  Wat doen de wieken van een windmolen?
Wat doen de wieken van een windmolen?  Hoe ver boven de aarde is iss?
Hoe ver boven de aarde is iss?  O-FIB:Far-field-geïnduceerde near-field-afbraak voor direct nanoschrijven in een atmosferische omgeving
O-FIB:Far-field-geïnduceerde near-field-afbraak voor direct nanoschrijven in een atmosferische omgeving Waarom ziet de maan er altijd uit als een cirkelvormig object in de lucht?
Waarom ziet de maan er altijd uit als een cirkelvormig object in de lucht?  Waar bevindt goud zich in Canada?
Waar bevindt goud zich in Canada?  Wanneer is de Hubble -telescoop gerepareerd?
Wanneer is de Hubble -telescoop gerepareerd?  Speleologen vinden slangen maar geen geesten in Yemens Well of Hell
Speleologen vinden slangen maar geen geesten in Yemens Well of Hell
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


