
Wetenschap
Waarom zou u verwachten dat een 1,5 M CACL2 -oplossing een lager vriespunt heeft dan NaCl -oplossing?
Point -depressie en colligatieve eigenschappen bevriezen
* Colligatieve eigenschappen: Dit zijn eigenschappen van oplossingen die alleen afhangen van de * concentratie * van opgeloste deeltjes, niet op hun identiteit. Bevriezende puntdepressie is zo'n eigenschap.
* Freezing Point Depression: Het vriespunt van een oplosmiddel wordt verlaagd wanneer er een opgeloste stof in wordt opgelost. Hoe groter de concentratie van opgeloste deeltjes, hoe groter de depressie.
De rol van dissociatie
* NaCl: Natriumchloride (NaCl) dissocieert in twee ionen in oplossing:Na⁺ en CL⁻. Dus een 1,5 M NaCl -oplossing heeft 3,0 m totale ionen (1,5 m NA⁺ + 1,5 m Cl⁻).
* cacl₂: Calciumchloride (CaCl₂) dissocieert in drie ionen in oplossing:ca²⁺ en 2cl⁻. Daarom heeft een 1,5 M CaCl₂ -oplossing 4,5 m totale ionen (1,5 m Ca²⁺ + 3,0 m Cl⁻).
Het belangrijkste verschil
Omdat CaCl₂ meer ionen in oplossing produceert dan NaCl in dezelfde molaliteit, zal het een groter effect hebben op het verlagen van het vriespunt.
Samenvattend
De 1,5 M CaCl₂ -oplossing heeft een lager vriespunt dan de 1,5 M NaCl -oplossing omdat deze een hogere concentratie opgeloste stofdeeltjes produceert, wat leidt tot een grotere depressie van het vriespunt.
 Brits stadsbos kan evenveel koolstof opslaan als tropische regenwouden
Brits stadsbos kan evenveel koolstof opslaan als tropische regenwouden De ergste vervuilers in het Noordpoolgebied zijn niet wat je denkt
De ergste vervuilers in het Noordpoolgebied zijn niet wat je denkt  Luchtvervuiling neemt af in Spanje na implementatie van maatregelen ter bestrijding van COVID-19
Luchtvervuiling neemt af in Spanje na implementatie van maatregelen ter bestrijding van COVID-19 EPA-chef gaat privé ontmoeten met leidinggevenden in de chemische industrie
EPA-chef gaat privé ontmoeten met leidinggevenden in de chemische industrie Hoe dik of dun is de atmosfeer van de aarde?
Hoe dik of dun is de atmosfeer van de aarde?
Hoofdlijnen
- Wat zijn expressievectoren in recombinante DNA -technologie?
- Wat is de eerste fase van fotosynthese?
- Nucleotide -subeenheid gemaakt van ribosesuikeradenine en fosfaten die transport opslaan?
- Zijn mitochondriën in planten verschillend van dieren?
- Sprinkhanenonderzoek zou ons kunnen vertellen waarom Elvis de voorkeur gaf aan boterhammen met pindakaas
- Wat zijn resultaten in de wetenschap?
- Wat is de naam voor een plantarts?
- Welk eiwit is dat?
- Hoe kan biotechnologie de opwarming van de aarde stoppen?
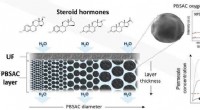
- Efficiënte verwijdering van steroïde hormonen uit water
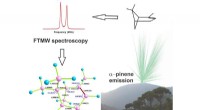
- De moleculaire structuur van een bosaroma gedeconstrueerd
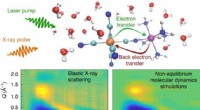
- Onderzoekers krijgen inzicht in hoe oplosmiddelmoleculen door licht gestuurde reacties beïnvloeden
- Wetenschappers gebruiken chemische hulpmiddelen om kankerverwekkende eiwitten op te sporen

- Een katalysator voor duurzame methanol

 Een robot gebruiken om robots in afgelegen oceanen in te zetten
Een robot gebruiken om robots in afgelegen oceanen in te zetten Wanneer een afgebroken deel van het lichaam zich ontwikkelt tot een nakomelingen?
Wanneer een afgebroken deel van het lichaam zich ontwikkelt tot een nakomelingen?  Wat is de samengestelde naam van RA3N2?
Wat is de samengestelde naam van RA3N2?  Eerste menselijke migratie uit Afrika meer geografisch verspreid dan eerder werd gedacht
Eerste menselijke migratie uit Afrika meer geografisch verspreid dan eerder werd gedacht Welk stuk apparatuur wordt gebruikt om kleine stukjes vaste stoffen op te pakken die te ofwel schadelijk zijn met je handen?
Welk stuk apparatuur wordt gebruikt om kleine stukjes vaste stoffen op te pakken die te ofwel schadelijk zijn met je handen?  Chemici tonen aan dat de katalyse van hemoproteïnen veel gecompliceerder is dan we dachten
Chemici tonen aan dat de katalyse van hemoproteïnen veel gecompliceerder is dan we dachten  Mechanisch regelbare niet-lineaire diëlektrica
Mechanisch regelbare niet-lineaire diëlektrica Begeleiding tijdens de eerste jaren van een biologie major leidt tot een hogere retentie van eerstegeneratiestudenten
Begeleiding tijdens de eerste jaren van een biologie major leidt tot een hogere retentie van eerstegeneratiestudenten
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

