
Wetenschap
Wat gebeurt er als ammoniumchloride wordt toegevoegd aan water?
1. Oplossing: De ionische bindingen in de ammoniumchloride kristalroosterbreuk en de individuele ionen (NH₄⁺ en CL⁻) worden in het water vrijgegeven.
2. Hydratatie: De vrijgegeven ionen worden omringd door watermoleculen. De positief geladen ammoniumionen (NH₄⁺) trekken de negatief geladen zuurstofuiteinden van watermoleculen aan, terwijl de negatief geladen chloride -ionen (CL⁻) de positief geladen waterstofuiteinden van watermoleculen aantrekken. Dit proces wordt hydratatie genoemd.
3. Vorming van een waterige oplossing: De gehydrateerde ionen zijn nu vrij om rond te bewegen in de oplossing en vormen een homogene mengsel van ammonium- en chloride -ionen in water.
Algemene reactie:
NH₄CL (S) + H₂o (L) → NH₄⁺ (aq) + Cl⁻ (aq)
belangrijke punten om op te merken:
* De oplossing wordt enigszins zuur vanwege de hydrolyse van ammoniumionen (NH₄⁺). Ammoniumionen kunnen een proton (H⁺) doneren aan watermoleculen, waardoor hydroniumionen (H₃o⁺) worden gevormd die de oplossing zuur maken.
* De oplossing van ammoniumchloride is een endotherm proces , wat betekent dat het warmte van de omgeving absorbeert. Dit kan worden waargenomen als een lichte afname van de temperatuur van het water.
* De pH van de oplossing zal afhangen van de concentratie ammoniumchloride. Hogere concentraties zullen resulteren in een lagere pH (zuurder).
Gebruik van ammoniumchloride:
Ammoniumchloride heeft verschillende toepassingen, waaronder:
* kunstmest: Biedt stikstof voor plantengroei
* Voedseladditief: Gebruikt als een gistvoedingsstof- en zuurgraadregulator
* geneeskunde: Gebruikt in hoestsiropen en slijbakkers
* Elektropatisering: Gebruikt als een elektrolyt
* textielindustrie: Gebruikt als een bijtante en in kleuring processen
 Waarom we de verstikte rivieren in Nieuw-Zeeland moeten vrijlaten om de impact van toekomstige overstromingen te verminderen
Waarom we de verstikte rivieren in Nieuw-Zeeland moeten vrijlaten om de impact van toekomstige overstromingen te verminderen  VN:68 procent van de wereldbevolking zal in 2050 in stedelijke gebieden wonen
VN:68 procent van de wereldbevolking zal in 2050 in stedelijke gebieden wonen Koningsgetijden zijn een blik in de toekomst met stijgende zeeën. Voor velen, overstromingen is het nieuwe normaal
Koningsgetijden zijn een blik in de toekomst met stijgende zeeën. Voor velen, overstromingen is het nieuwe normaal Wat is het antwoord op diversiteit?
Wat is het antwoord op diversiteit?  Hoe ga je de aard bepalen zonder spiegel aan te raken?
Hoe ga je de aard bepalen zonder spiegel aan te raken?
Hoofdlijnen
- Stijgende temperaturen veranderen grote populatie zeeschildpadden vrouw
- Wat is de wetenschappelijke naam voor pilootwalvissen?
- Het is goed om zeldzaam te zijn, voor sommige soorten
- Wat is het toegangspunt van eiwitten in cellulaire ademhaling?
- Hoe moleculaire spieren cellen helpen delen
- Kan een criticus die een gelovige is geworden, anderen beïnvloeden? Het geval van genetisch gemodificeerd voedsel
- Welk celgedeelte regelt de activiteiten?
- Hoe organiseren wetenschappers?
- Wat zijn de zelfregulerende controlemechanismen die meestal werken door een proces dat wordt genoemd?
- Hoe goede metalen slecht worden:ontdekking verklaart onverwachte eigenschappen van exotische metaalverbindingen

- Wetenschappers ontwerpen materiaal dat energie kan opslaan als een adelaarsgreep
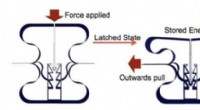
- Onderzoekers kijken naar interactie tussen olie en water om waterverontreiniging te voorkomen

- Kunstmatige intelligentie helpt bij de fabricage van materialen

- Doorzeefd met gaten:flexibele dunnefilmelektronica duurzamer maken
 Hoe is het smeltpunt van D-Sorbitol?
Hoe is het smeltpunt van D-Sorbitol?  Kanker-kameleons: hoe sommige agressieve kankercellen chemotherapie “hacken”
Kanker-kameleons: hoe sommige agressieve kankercellen chemotherapie “hacken”  Wat heeft waterdamp nodig om van een gasvloeistof te veranderen?
Wat heeft waterdamp nodig om van een gasvloeistof te veranderen?  Is het waar dat een langzaam bewegend object meer kinetische energie snelle objecten heeft?
Is het waar dat een langzaam bewegend object meer kinetische energie snelle objecten heeft?  Wat is een hulpmiddel dat wordt gebruikt om twee objecten bij elkaar te houden?
Wat is een hulpmiddel dat wordt gebruikt om twee objecten bij elkaar te houden?  Engineering single-molecule fluorescentie met asymmetrische nano-antennes
Engineering single-molecule fluorescentie met asymmetrische nano-antennes Wat is de rol van EtBr bij elektroforese?
Wat is de rol van EtBr bij elektroforese?  Hoe sociale wetenschappen kunnen helpen nieuwe wegen uit de klimaatcrisis te vinden
Hoe sociale wetenschappen kunnen helpen nieuwe wegen uit de klimaatcrisis te vinden
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

