
Wetenschap
Waarom heeft Diamond een hoger smeltpunt dan natriumchloride?
1. Bondtype:
* diamant: Diamant wordt bij elkaar gehouden door sterke covalent bindingen . Elk koolstofatoom deelt elektronen met vier andere koolstofatomen, die een rigide, driedimensionale netwerkstructuur vormen. Deze covalente bindingen zijn ongelooflijk sterk en vereisen veel energie om te breken.
* Natriumchloride: Natriumchloride wordt bij elkaar gehouden door ionische bindingen . Natrium (NA) atomen verliezen een elektron om positief geladen ionen (Na+) te worden, terwijl chloor (CL) atomen een elektron krijgen om negatief geladen ionen te worden (Cl-). Deze tegengesteld geladen ionen trekken elkaar aan en vormen een ionisch kristalrooster. Hoewel ionische bindingen sterker zijn dan intermoleculaire krachten, zijn ze aanzienlijk zwakker dan covalente bindingen.
2. Kristalstructuur:
* diamant: De covalente netwerkstructuur van Diamond strekt zich uit over het hele kristal, waardoor het extreem rigide en bestand is tegen breuk.
* Natriumchloride: Natriumchloride heeft een meer losjes gepakte kristalroosterstructuur, waar ionen in een regelmatig patroon zijn gerangschikt. Deze structuur is minder stabiel en kan gemakkelijker worden afgebroken.
3. Elektronische configuratie:
* diamant: De sterke covalente bindingen in diamant creëren een zeer stabiele elektronische configuratie met alle valentie -elektronen die deelnemen aan binding. Dit maakt het moeilijk om de structuur te verstoren en het materiaal te smelten.
* Natriumchloride: In natriumchloride hebben de ionen relatief losjes elektronen vastgehouden, die gemakkelijker kunnen worden verstoord door thermische energie, wat leidt tot een lager smeltpunt.
4. Van der Waals Forces:
* diamant: Er zijn geen significante Van der Waals -krachten aanwezig in diamant vanwege de sterke covalente binding.
* Natriumchloride: Hoewel ionische bindingen de primaire kracht zijn in natriumchloride, dragen zwakkere van der Waals -krachten tussen de ionen ook bij aan de stabiliteit van het kristal. Deze krachten zijn relatief zwak en kunnen gemakkelijk worden overwonnen door thermische energie.
Samenvattend maakt de sterke covalente binding, rigide netwerkstructuur en stabiele elektronische configuratie van diamant het aanzienlijk beter bestand tegen smelten dan natriumchloride, dat wordt bij elkaar gehouden door zwakkere ionische bindingen en een meer losverpakte kristale roosterstructuur heeft.
 Zoutere waterwegen creëren gevaarlijke chemische cocktails
Zoutere waterwegen creëren gevaarlijke chemische cocktails Wetenen wetenschap en religie elkaar in tegenspraak?
Wetenen wetenschap en religie elkaar in tegenspraak?  Amerikaanse regering onthult definitief monumentplan voor Utah
Amerikaanse regering onthult definitief monumentplan voor Utah Nieuwe ontdekking suggereert dat er in de jaren veertig een aanzienlijke terugtrekking van de gletsjers in West-Antarctica begon
Nieuwe ontdekking suggereert dat er in de jaren veertig een aanzienlijke terugtrekking van de gletsjers in West-Antarctica begon  Aardbeving van vulkaan Etna schokt Sicilië, leidt tot paniek
Aardbeving van vulkaan Etna schokt Sicilië, leidt tot paniek
Hoofdlijnen
- Wat is het Forer-effect?
- Wat is het belangrijkste idee van bacteriën?
- Wat is een biostitute?
- Waarom zijn vervalbacteriën van levensbelang voor het leven op aarde?
- Wat is BPA en waarom zit het in zoveel plastic producten?
- Onderzoek zou de weg kunnen vrijmaken voor een beter begrip van de manier waarop planten en dieren groeien en zich ontwikkelen
- Hoe verhoudt het metabolisme zich tot enzymen?
- Hoe worden de codes voor eiwitten van kern naar ribosomen gedragen?
- Kenmerken van micro-organismen
- 2D-materialen tot het uiterste brengen
- Een nieuw idee verbindt de synthese van klei en de oorsprong van het metabolisme

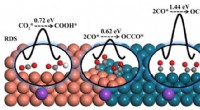
- Afstemming van reactiebarrières voor elektroreductie van kooldioxide tot producten met meerdere koolstofatomen
- Mensen inspireren om betere levensstijlkeuzes te maken - door middel van isotopen

- Kunstmatige fotosynthese krijgt grote boost van nieuwe katalysator

 Welk type rotsen vormen zich wanneer lava afkoelt na een vulkanische uitbarsting?
Welk type rotsen vormen zich wanneer lava afkoelt na een vulkanische uitbarsting?  Klimaatkosten het laagst als opwarming beperkt blijft tot 2 graden Celsius
Klimaatkosten het laagst als opwarming beperkt blijft tot 2 graden Celsius Hoe insecten verschillende suikers uit elkaar houden
Hoe insecten verschillende suikers uit elkaar houden  Beschermen we rivieren en beken echt tegen vervuiling? Het is moeilijk te zeggen, en dat is een probleem
Beschermen we rivieren en beken echt tegen vervuiling? Het is moeilijk te zeggen, en dat is een probleem Welke materialen zijn goede of slechte warmtegeleiders?
Welke materialen zijn goede of slechte warmtegeleiders?  Wat is de oorsprong van blaasjes in basalt?
Wat is de oorsprong van blaasjes in basalt?  Wie heeft de meeste Apollo -vluchten gemaakt?
Wie heeft de meeste Apollo -vluchten gemaakt?  Wat is de relatieve positie voor de zon?
Wat is de relatieve positie voor de zon?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

