
Wetenschap
Waarom heeft berylliumchloride een meer covalent karakter dan bariumchloride?
* kleinere maat en hogere ladingsdichtheid van beryllium: Beryllium is een veel kleiner atoom dan barium. Dit betekent dat de positieve lading van het beryllium -ion geconcentreerd is over een kleiner gebied, waardoor een hogere ladingsdichtheid ontstaat. Deze sterke positieve lading trekt de elektronenwolk van chloor effectiever aan, wat leidt tot een grotere mate van covalente karakter.
* Hoger elektronegativiteitsverschil: Het elektronegativiteitsverschil tussen beryllium en chloor is kleiner dan dat tussen barium en chloor. Dit verschil is een maat voor de neiging van een atoom om elektronen aan te trekken. Een kleiner elektronegativiteitsverschil duidt op een meer covalent karakter.
* Polariseerbaarheid van het kation: Beryllium -ion (be²⁺) is veel meer polariseerbaar dan bariumion (ba²⁺). Dit betekent dat de elektronenwolk van beryllium gemakkelijker kan worden vervormd door de negatieve lading van het chloorion, wat leidt tot een grotere mate van covalente karakter.
Samenvattend draagt de kleinere omvang, hogere ladingsdichtheid en een grotere polariseerbaarheid van beryllium, gecombineerd met het kleinere elektronegativiteitsverschil tussen beryllium en chloor, bij aan het meer covalent karakter van berylliumchloride vergeleken met bariumchloride.
Opmerking: Het is belangrijk om te onthouden dat het concept van "ionisch" of "covalent" vaak een spectrum is, en veel verbindingen vertonen kenmerken van beide. Hoewel berylliumchloride een meer covalent karakter vertoont, is het niet strikt een covalente verbinding en bezit het nog steeds enkele ionische eigenschappen.
 Welke zijn polyatomische ionen hydroxidechlorideammonium en carbonaat?
Welke zijn polyatomische ionen hydroxidechlorideammonium en carbonaat?  Onderzoekers ontdekken hoe ze protonen kunnen verplaatsen en de waterstofbrandstofceltechnologie kunnen verbeteren
Onderzoekers ontdekken hoe ze protonen kunnen verplaatsen en de waterstofbrandstofceltechnologie kunnen verbeteren  Is Strontium een metaal of niet -metaal?
Is Strontium een metaal of niet -metaal?  Mineralen zijn substantie samengesteld uit twee of meer elementen die in duidelijke verhoudingen aan elkaar zijn verbonden?
Mineralen zijn substantie samengesteld uit twee of meer elementen die in duidelijke verhoudingen aan elkaar zijn verbonden?  Wat is de oxidatietoestand van boor in peroxoboraat -ion?
Wat is de oxidatietoestand van boor in peroxoboraat -ion?
 UKs eerste Urban Observatory biedt een uniek inzicht in hoe onze steden werken
UKs eerste Urban Observatory biedt een uniek inzicht in hoe onze steden werken Wolkradarsimulator overbrugt kloof tussen klimaatmodellen en veldgegevens
Wolkradarsimulator overbrugt kloof tussen klimaatmodellen en veldgegevens Stijgende broeikasgassen vormen een voortdurende bedreiging voor de Arctische ozonlaag
Stijgende broeikasgassen vormen een voortdurende bedreiging voor de Arctische ozonlaag Sociologen debatteren over de vraag:zijn Amerikanen werkelijk geïsoleerd?
Sociologen debatteren over de vraag:zijn Amerikanen werkelijk geïsoleerd?  Recordhitterot cacaobonen bedreigt de landbouw in Ivoorkust
Recordhitterot cacaobonen bedreigt de landbouw in Ivoorkust
Hoofdlijnen
- Wat was het eerste organisme en hoe overleefde het vroege omstandigheden?
- Wat is de functie, heeft het vetweefsel in vetten?
- 45 jaar later:hoe serotonine schistosome parasieten laat bewegen
- Welke 2 planten die zaden gebruiken om zich te voortplanten?
- Studies leveren een beter begrip op van hoe cyanobacteriën voordeel halen uit glucose
- Wat is de dectiteit?
- Wat zijn de twee brede gebruiksgebieden en voorbeelden na een in kweek gekweekte gastheercel om klooncellen te vormen die gekloond genbelang bevatten?
- De processen die een organisme in staat stellen te overleven?
- Wereldwijde visbestanden kunnen niet worden hersteld als er niets wordt gedaan om klimaatverandering en overbevissing een halt toe te roepen, suggereert nieuw onderzoek
- Past één maat allemaal? Een nieuw model voor organische halfgeleiders

- Het onderwaterleven belooft wat voor het doden van tuberculose

- De structuur van RNA ontdekken
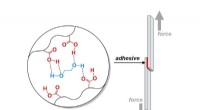
- Hoe maak je lijmen voor elektronica, voertuigen, en moeilijker bouwen?
- Efficiënte verwijdering van radionucliden U(VI) door nanomaterialen van staafvormig metaalorganisch raamwerk (MOF-5)

 Bestaat er centripetale kracht in de ruimte?
Bestaat er centripetale kracht in de ruimte?  Deliveroo zegt dat verliezen toenemen, om Nederland te verlaten
Deliveroo zegt dat verliezen toenemen, om Nederland te verlaten Wat zijn de metalen warmtegeleidingspiegels?
Wat zijn de metalen warmtegeleidingspiegels?  Natuurkundigen leggen eerste beelden vast van atoomspin
Natuurkundigen leggen eerste beelden vast van atoomspin Wereldwijd gebruikte angstdrug tegen lage kosten uit afvalwater verwijderen
Wereldwijd gebruikte angstdrug tegen lage kosten uit afvalwater verwijderen Methoden voor het maken van Opals in een Lab
Methoden voor het maken van Opals in een Lab  Wat is materiaal dat vaak wordt gebruikt om draden te isoleren, elektriciteit geroepen?
Wat is materiaal dat vaak wordt gebruikt om draden te isoleren, elektriciteit geroepen?  Wetenschappers vinden meteoriet uit de geboorte van het zonnestelsel
Wetenschappers vinden meteoriet uit de geboorte van het zonnestelsel
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

