
Wetenschap
Wat is de oxidatietoestand van boor in peroxoboraat -ion?
* zuurstof: Zuurstof heeft meestal een oxidatietoestand van -2, behalve in peroxiden (zoals O2²⁻) waar het een oxidatietoestand van -1 heeft.
* waterstof: Waterstof heeft meestal een oxidatietoestand van +1.
* Algemeen lading: Het peroxoboraat -ion heeft een lading van -1.
Laten we de oxidatie -staten afbreken:
* Twee peroxidegroepen (O2²⁻): Elke peroxidegroep heeft twee zuurstofatomen met een oxidatietoestand van -1, wat in totaal -2 per peroxidegroep oplevert. Aangezien er twee peroxidegroepen zijn, is de totale bijdrage van peroxide -zuurstof -4.
* Twee hydroxidegroepen (oh⁻): Elke hydroxidegroep heeft één zuurstofatoom met een oxidatietoestand van -2 en één waterstofatoom met een oxidatietoestand van +1. Dit geeft een netto oxidatietoestand van -1 per hydroxidegroep en in totaal -2 voor beide.
Laten we nu de oxidatietoestand van Boron vertegenwoordigen als 'x':
x + (-4) + (-2) =-1
Oplossen voor x:
x =-1 + 4 + 2 =+5
Daarom is de oxidatietoestand van boor in het peroxoboraat -ion +5.
 Welke formule vertegenwoordigt een stof die covalente bindingen bevat?
Welke formule vertegenwoordigt een stof die covalente bindingen bevat?  Gebruik van zeewater
Gebruik van zeewater  Hebben verbindingen niet dezelfde eigenschappen als elementen die ze hebben gevormd?
Hebben verbindingen niet dezelfde eigenschappen als elementen die ze hebben gevormd?  Tools gebruikt om temperatuur te meten
Tools gebruikt om temperatuur te meten  Wat moet worden gebruikt om een precieze meting van het vloeibare volume te maken?
Wat moet worden gebruikt om een precieze meting van het vloeibare volume te maken?
 In welke zin is de relatie niet geanalyseerd?
In welke zin is de relatie niet geanalyseerd?  Wat is het wetenschappelijke verschil tussen warm weer en koud weer?
Wat is het wetenschappelijke verschil tussen warm weer en koud weer?  NASA meet regenval in tropische cycloon Donna
NASA meet regenval in tropische cycloon Donna Wat zijn enkele positieve effecten van een orkaan?
Wat zijn enkele positieve effecten van een orkaan?  Vuurwerk op 4 juli veroorzaakte het op één na hoogste niveau van luchtvervuiling sinds de vakantie in Zuid-Californië in tien jaar
Vuurwerk op 4 juli veroorzaakte het op één na hoogste niveau van luchtvervuiling sinds de vakantie in Zuid-Californië in tien jaar
Hoofdlijnen
- Bepalen genen al uw geërfde eigenschappen?
- Wat gebeurt er met glucose die niet wordt gebruikt voor enige ademhaling in plantencellen?
- Processen die ATP gebruiken als energiebron
- Het karpervirus dat onderzoekers leerde over immunologie
- Welk lichaamssysteem reguleert activiteiten door zenuwimpulsen?
- Nieuwe aanpak breidt de kwantificering van de uitwisseling van voedingsstoffen in plantenweefsels, de rhizosfeer en de bodem uit
- Waarom meiose en gametogenese altijd onderling verbonden zijn?
- Wanneer zijn dinosauriërs uitgestorven? De theorieën over hoe het gebeurde en wat overleefde
- Wie is verantwoordelijk voor het dubbele helixmodel?
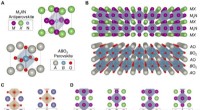
- Epitaxiale antiperovskiet/perovskiet heterostructuren voor materiaalontwerp
- Melkmoleculen van microben

- Het bedekken van metalen katalysatoroppervlakken met dunne tweedimensionale oxidematerialen kan chemische reacties versterken
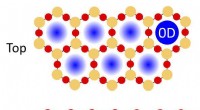
- DNA-sjablonen gebruiken om de energie van de zon te benutten

- Forensisch chemicus gebruikt zweet om personen op plaats delict te onderscheiden

 In welke draad is de zekering altijd geplaatst?
In welke draad is de zekering altijd geplaatst?  De zaak van de ontbrekende diamanten
De zaak van de ontbrekende diamanten De experimentele demonstratie van een verifieerbaar blind kwantumcomputerprotocol
De experimentele demonstratie van een verifieerbaar blind kwantumcomputerprotocol  Welk metaal heeft twee valentie -elektronen?
Welk metaal heeft twee valentie -elektronen?  Top 5 mineralen en rotsen gevonden in Arkansas?
Top 5 mineralen en rotsen gevonden in Arkansas?  Als de uiteindelijke snelheid lager zal zijn dan het initiële object verhoogt de snelheid of afnemende snelheid?
Als de uiteindelijke snelheid lager zal zijn dan het initiële object verhoogt de snelheid of afnemende snelheid?  Is Apollo, de god van het licht, hetzelfde als oorlog?
Is Apollo, de god van het licht, hetzelfde als oorlog?  Experimenten valideren de mogelijkheid van heliumregen in Jupiter en Saturnus
Experimenten valideren de mogelijkheid van heliumregen in Jupiter en Saturnus
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

