
Wetenschap
Wat is de uiteindelijke concentratie als 100 ml water wordt toegevoegd aan 25,0 6,0 m NaCl?
1. Begrijp verdunning
Verdunning is het proces van het verminderen van de concentratie van een oplossing door meer oplosmiddel toe te voegen (in dit geval water). Het belangrijkste principe is dat de hoeveelheid opgeloste stof (NaCl) hetzelfde blijft, maar het is in een groter volume verdeeld.
2. Bereken de mol NaCl
* molariteit (m) =mol opgeloste stof / liters van oplossing
* We hebben 25,0 ml van een NaCl -oplossing van 6,0 m, dat is 0,025 L.
* De formule herschikken: mol NaCl =Molarity X Liters
* mol NaCl =6,0 m x 0,025 L =0,15 mol
3. Bereken het uiteindelijke volume
* Eerste volume =25,0 ml
* Volume toegevoegd =100 ml
* Eindvolume =25,0 ml + 100 ml =125 ml =0,125 l
4. Bereken de uiteindelijke concentratie
* molariteit (m) =mol opgeloste stof / liters van oplossing
* Molariteit =0,15 mol / 0,125 l = 1,2 m
Daarom is de uiteindelijke concentratie van de NaCl -oplossing 1,2 m.
 Bedreiging voor Florida neemt af, aangezien Isaias naar verwachting een tropische storm zal blijven
Bedreiging voor Florida neemt af, aangezien Isaias naar verwachting een tropische storm zal blijven Modellering van de effecten van afvalwaterinjectie
Modellering van de effecten van afvalwaterinjectie Verbergt de opwarming van de aarde zich onder water?
Verbergt de opwarming van de aarde zich onder water?  Klimaatcrisis:hoe maak je ruimte voor 2 miljard bomen op een druk eiland als het VK?
Klimaatcrisis:hoe maak je ruimte voor 2 miljard bomen op een druk eiland als het VK? Tropische storm Elsa nadert Cuba te midden van angst voor overstromingen
Tropische storm Elsa nadert Cuba te midden van angst voor overstromingen
Hoofdlijnen
- Onderzoekers onderzoeken hoe neuronen kansverdelingen bemonsteren
- Kunnen stereotypen worden gekwantificeerd?
- Welke groepen vergelijkbare cellen die hetzelfde functioneren uitvoeren zijn?
- Wat is de aandoening dat sommige lichaamscellen het vermogen verliezen om de groei te beheersen?
- Wat zijn de sleutelwoorden voor oplossing in de wetenschap?
- Welk onderzoekslaboratorium permanent in een baan rond EART?
- Welke kenmerken delen de meeste bacteriën?
- Waarom is kruisingplanten een voorbeeld van biotechnologie?
- Waar bevindt zich DNA in plantencellen?
- Gerookt voedsel is lekkerder, minder schadelijk met een tip van de auto-industrie

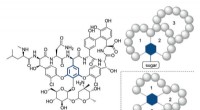
- Eenvoudige éénpotssynthese van medicamenteuze tricyclische peptiden
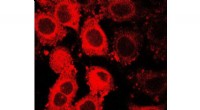
- GLUT5 fluorescerende sonde vingerafdrukken kankercellen
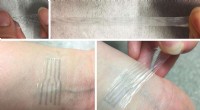
- Ingenieurs ontwikkelen een plastic elektrode die uitrekt als rubber, maar elektriciteit transporteert als draden
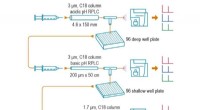
- Verbeterde eiwitanalyse kan vroege ziektedetectie helpen
 Hoeveel joules van fossiele brandstofenergie zouden we per persoon gebruiken?
Hoeveel joules van fossiele brandstofenergie zouden we per persoon gebruiken?  Bosbranden in Californië:oplossingen zoeken voor een wicked problem
Bosbranden in Californië:oplossingen zoeken voor een wicked problem Creatie zonder contact in de botsingen van lood- en goudkernen
Creatie zonder contact in de botsingen van lood- en goudkernen Wat zijn de natuurlijke resouces?
Wat zijn de natuurlijke resouces?  Wat is de naam en chemische formule voor gas waardoor professor stem veranderde?
Wat is de naam en chemische formule voor gas waardoor professor stem veranderde?  Welke bacterieën produceren zuurstof?
Welke bacterieën produceren zuurstof?  Onderzoek toont potentieel aan om verlaten kankermedicijn nieuw leven in te blazen door medicijnafgifte door nanodeeltjes
Onderzoek toont potentieel aan om verlaten kankermedicijn nieuw leven in te blazen door medicijnafgifte door nanodeeltjes Onderzoekers ontwikkelen nanotrain voor gericht transport van kankermedicijnen
Onderzoekers ontwikkelen nanotrain voor gericht transport van kankermedicijnen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

