
Wetenschap
Wanneer 1,326 g metalen sulfide werd geroosterd in lucht 0,824 oxide gevormd als het oxidatienummer 2 is welk molaire massa metaal?
1. Schrijf de gebalanceerde chemische vergelijking
De algemene reactie voor het roosteren van een metalen sulfide is:
2 MS + 3 O₂ → 2 Mo + 2 So₂
Waar:
* M is het metaal
* S is zwavel
* O is zuurstof
2. Bereken de massa van zwavel verloren
* Massa sulfide =1.326 g
* Massa van oxide =0,824 g
* Massa van zwavel verloren =massa sulfide - oxidemassa =1,326 g - 0,824 g =0,502 g
3. Bereken de mol zwavel verloren
* Molaire massa van zwavel (s) =32,06 g/mol
* Mol zwavel =massa zwavel / molaire massa van zwavel =0,502 g / 32,06 g / mol =0,0156 mol
4. Bereken de mol metaaloxide gevormd
* Uit de evenwichtige vergelijking produceren 2 mol MS 2 mol mo.
* Daarom zijn de gevormde mol metaaloxide gelijk aan de mol zwavel verloren:0,0156 mol.
5. Bereken de massa van metaaloxide gevormd
* Mol metaaloxide =0,0156 mol
* Massa van metaaloxide =0,824 g (gegeven)
* Molaire massa metaaloxide =massa metaaloxide / mol metaaloxide =0,824 g / 0,0156 mol =52,82 g / mol
6. Bereken de molaire massa van het metaal
* Molaire massa van metaaloxide (MO) =molaire massa van metaal (m) + molmassa van zuurstof (O)
* Molaire zuurstofmassa (O) =16,00 g/mol
* Molaire metaalmassa (m) =molaire massa van metaaloxide - molmassa van zuurstof =52,82 g/mol - 16,00 g/mol =36,82 g/mol
Daarom is de molaire massa van het metaal ongeveer 36,82 g/mol.
Opmerking: Het oxidatienummer van het metaal wordt gegeven als +2, wat consistent is met de algemene formule voor metalen sulfiden (MS) en oxiden (MO). Deze informatie is niet nodig voor de werkelijke berekening, maar helpt de veronderstelde chemische vergelijking te verifiëren.
 Welke stoffen hebben de laagste pH van 0?
Welke stoffen hebben de laagste pH van 0?  Plastic web printen om de gsm-schermen van de toekomst te beschermen
Plastic web printen om de gsm-schermen van de toekomst te beschermen Onderzoek toont aan hoe AI in slechts 30 minuten antibioticaresistentie kan detecteren
Onderzoek toont aan hoe AI in slechts 30 minuten antibioticaresistentie kan detecteren  Wat gebeurt er als natriumfosfaat wordt gemengd met kopersulfaat?
Wat gebeurt er als natriumfosfaat wordt gemengd met kopersulfaat?  Veiligheidscontrolelijst vóór het lassen
Veiligheidscontrolelijst vóór het lassen
 Elke ademhaling die je neemt:het traject volgen van de vervuiling door ingeademde plasticdeeltjes
Elke ademhaling die je neemt:het traject volgen van de vervuiling door ingeademde plasticdeeltjes  Vluchten geschrapt omdat nieuwe vulkaanuitbarstingen de Canarische Eilanden troffen
Vluchten geschrapt omdat nieuwe vulkaanuitbarstingen de Canarische Eilanden troffen Gesprekken over een mondiaal plasticverdrag beginnen in Canada
Gesprekken over een mondiaal plasticverdrag beginnen in Canada  Wat gebeurt er nadat vulkanen zijn afgebroken?
Wat gebeurt er nadat vulkanen zijn afgebroken?  Wat bepaalt de toestand van de materie?
Wat bepaalt de toestand van de materie?
Hoofdlijnen
- Wetenschappers onderzoeken hoe verschillende vloeibare organellen in cellen worden gecreëerd
- Beeldstabilisatie bij gewervelde dieren hangt af van contrast tussen objecten
- Wat zijn neurale cellen?
- Onderzoek laat zien hoe een enkel enzym de productie van sojaolie kan stimuleren
- Wat wordt bedoeld met wetenschappelijk en onwetenschappelijk werk?
- Hoe evolutie werkt
- Natuurlijke biosurfactanten:de toekomst van milieuvriendelijke vleesconservering
- Onderzoekers ontdekken hoe gelei-zeedieren moderne robotica kunnen vormen
- Hoe microhabitat bacteriële gemeenschappen in een semi-aride ecosysteem beïnvloedt
- Onderzoek kan de kosten van elektronenbronnen drastisch verlagen
- Boornitride vernietigt voor altijd chemicaliën PFOA, GenX
- Synthese van waardevolle chemicaliën uit verontreinigde grond

- Simuleren en optimaliseren van industriële spinprocessen
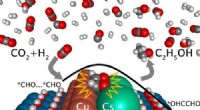
- Katalysatorstudie bevordert de conversie van kooldioxide naar ethanol
 Wat is het gewicht op aarde met een massa van 80 kg?
Wat is het gewicht op aarde met een massa van 80 kg?  Onderzoekers stellen nieuwe grenzen aan de massa van leptoquarks
Onderzoekers stellen nieuwe grenzen aan de massa van leptoquarks NASA hoopt dat lancering in Nieuw-Zeeland de weg vrijmaakt voor maanlanding
NASA hoopt dat lancering in Nieuw-Zeeland de weg vrijmaakt voor maanlanding De zaï-techniek:hoe boeren in de Sahel gewassen verbouwen met weinig tot geen water
De zaï-techniek:hoe boeren in de Sahel gewassen verbouwen met weinig tot geen water  Google stopt met Google Translate op het vasteland van China
Google stopt met Google Translate op het vasteland van China Welk type lipide wordt geclassificeerd als een ringstructuur?
Welk type lipide wordt geclassificeerd als een ringstructuur?  Energie stroomt op verschillende manieren door de omgeving. Alle manieren waarop energie beweegt en wordt opgeslagen, kan worden verklaard door wettelijke behoud welke dat stelt dat?
Energie stroomt op verschillende manieren door de omgeving. Alle manieren waarop energie beweegt en wordt opgeslagen, kan worden verklaard door wettelijke behoud welke dat stelt dat?  Waarom moet je energie manipuleren?
Waarom moet je energie manipuleren?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

