
Wetenschap
Hoe beïnvloedt de temperatuur de volgorde van een reactie?
1. Botsingstheorie en activeringsenergie:
* botsingen: Reacties gebeuren wanneer moleculen botsen met voldoende energie om bestaande bindingen te verbreken en nieuwe te vormen.
* Activatie -energie (EA): Dit is de minimale energie die nodig is om moleculen te reageren.
* de rol van de temperatuur: Hogere temperaturen verhogen de gemiddelde kinetische energie van moleculen, wat leidt tot:
* frequentere botsingen: Moleculen bewegen sneller en botsen vaker.
* Botsingen met een hogere energie: Meer botsingen hebben voldoende energie om de activeringsenergiebarrière te overwinnen.
2. De Arrhenius -vergelijking:
Deze vergelijking kwantificeert wiskundig de relatie tussen temperatuur en reactiesnelheid:
* k =a * exp (-ea/rt)
* k: Snelheid constant (een maat voor reactiesnelheid)
* a: Pre-exponentiële factor (gerelateerd aan botsingsfrequentie)
* ea: Activeringsenergie
* r: Ideale gasconstante
* t: Temperatuur in Kelvin
3. Impact op reactieorder:
Hoewel temperatuur de reactieorder niet direct verandert (die wordt bepaald door de stoichiometrie en het mechanisme), kan het dit op verschillende manieren indirect beïnvloeden:
* snellere tarieven: Hogere temperaturen leiden in het algemeen tot snellere reacties. Dit kan het moeilijker maken om de reactieorder experimenteel te bepalen, omdat reacties te snel kunnen doorgaan om de snelheid nauwkeurig te meten.
* verschuivende evenwicht: Voor omkeerbare reacties kunnen temperatuurveranderingen de evenwichtspositie verschuiven, wat leidt tot een verandering in de schijnbare volgorde bij verschillende temperaturen.
* Concurrerende reacties: Als meerdere reacties gelijktijdig optreden, kan de temperatuur de relatieve snelheden van deze reacties beïnvloeden, wat de algehele waargenomen reactieorde beïnvloedt.
4. Voorbeelden:
* Ontleding van N2O5: Deze reactie is de eerste orde. Het verhogen van de temperatuur verhoogt de snelheid aanzienlijk, maar de volgorde blijft hetzelfde.
* Hydrogenering van ethyleen: Deze reactie is nul-orde bij hoge temperaturen als gevolg van de oppervlakte-verzadiging van de katalysator. Het verlagen van de temperatuur kan de volgorde veranderen naarmate het oppervlak minder verzadigd raakt.
Samenvattend:
Temperatuur is een krachtige factor die de reactiesnelheden beïnvloedt. Het verandert de reactieorde zelf niet, maar kan aanzienlijk beïnvloeden hoe we de volgorde meten en begrijpen door de invloed ervan op de botsfrequentie, activeringsenergie en de relatieve percentages van concurrerende reacties.
 Wat is de topografie van een bladverliezend bos?
Wat is de topografie van een bladverliezend bos?  De kliffen van Zuid-Californië verliezen het einde van de stijgende zee
De kliffen van Zuid-Californië verliezen het einde van de stijgende zee Nieuwe studie heeft een andere benadering om menselijke activiteit aan te tonen die aardbevingen in Texas veroorzaakt
Nieuwe studie heeft een andere benadering om menselijke activiteit aan te tonen die aardbevingen in Texas veroorzaakt NASA ziet Nakri sterker worden tot Typhoon
NASA ziet Nakri sterker worden tot Typhoon Een gecombineerde invloed van drie oceanen op recordbrekende regenval boven China in juni 2020
Een gecombineerde invloed van drie oceanen op recordbrekende regenval boven China in juni 2020
Hoofdlijnen
- Welke beren zijn herbivoren?
- Hoe veranderde de functie van de voorpoten toen gewervelde dieren ledematen kregen en naar het land trokken?
- Wat maakt een kwal?
- Waarom we niet meer verliefd moeten worden op schilferige witte vis
- Welke vorm van bacterie is tyfus?
- Wat is bacteriën op de een of andere manier verantwoordelijk voor alle op één behalve een van de processenomgeving?
- Welke van de volgende organismen zijn het nauwst gerelateerd aan ursus arctos en maritimus bfelis ursus cfelis felis dursus felis felis?
- Wat zijn de monomeren van koolhydraten?
- Verband tussen nummervolgorde en ritmische timing bij zangvogels
- Onderzoekers stellen een eenstapsstrategie voor om op grafeen gebaseerde composietfaseveranderingsmaterialen te synthetiseren
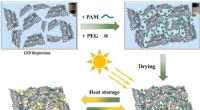
- Ontwikkeling van gefibrilleerde cellulose als duurzaam technologisch materiaal

- Atomaire vingerafdruk identificeert emissiebronnen van uranium

- 'S Werelds eerste demonstratie van aanhoudende luminescentie van organische materialen, klaar om nieuwe, uitgebreid gebruik
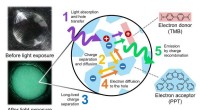
- Kristaloorlogen:onderzoek kan leiden tot efficiëntere methoden voor kristaltechnologie

 Wat een object is, heeft een zwaartekrachtpotentiaal energie van 41772.5 J en massa 1550 kg. Hoe hoog is het boven de grond?
Wat een object is, heeft een zwaartekrachtpotentiaal energie van 41772.5 J en massa 1550 kg. Hoe hoog is het boven de grond?  Hoe zorgt Catalyst mogelijk dat een reactie sneller kan gebeuren?
Hoe zorgt Catalyst mogelijk dat een reactie sneller kan gebeuren?  Hoe worden lengte en volume gemeten?
Hoe worden lengte en volume gemeten?  Grafeen:een nieuw hulpmiddel om gaatjes en tandvleesaandoeningen te bestrijden?
Grafeen:een nieuw hulpmiddel om gaatjes en tandvleesaandoeningen te bestrijden?  Hoe is natuurkunde in dans?
Hoe is natuurkunde in dans?  Wat is het pad van de schaduw over het aardoppervlak?
Wat is het pad van de schaduw over het aardoppervlak?  Hard Rock in de diepzee - de weg naar het ontcijferen van biodiversiteit op de zeebodem is steniger dan eerder werd aangenomen
Hard Rock in de diepzee - de weg naar het ontcijferen van biodiversiteit op de zeebodem is steniger dan eerder werd aangenomen Wetenschappers ontdekken een eeuwenoud geval van identiteitsverwisseling in de Chesapeake Bay
Wetenschappers ontdekken een eeuwenoud geval van identiteitsverwisseling in de Chesapeake Bay
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

