
Wetenschap
Wat is een zwakke interactie met waterstofatoom en fluorzuurstof of stikstofatoom?
Hier is hoe het werkt:
* elektronegativiteit: Het elektronegatieve atoom (F, O of N) trekt elektronendichtheid weg van het waterstofatoom, waardoor een gedeeltelijke positieve lading op de waterstof (8+) en een gedeeltelijke negatieve lading op het elektronegatieve atoom (Δ-) ontstaat.
* Dipole-dipole interactie: Dit creëert een dipoolmoment, waarbij de positief geladen waterstof wordt aangetrokken tot het negatief geladen elektronegatieve atoom op een naburig molecuul.
* waterstofbinding: Deze aantrekkingskracht tussen het Δ+ waterstof en Δ-elektronegatief atoom wordt een waterstofbinding genoemd.
Voorbeelden:
* water (h₂o): De waterstofatomen in één watermolecuul vormen waterstofbruggen met de zuurstofatomen in andere watermoleculen. Dit is de reden waarom water een hoog kookpunt heeft en een goed oplosmiddel is.
* DNA: Waterstofbindingen houden de twee DNA -strengen bij elkaar, waardoor de genetische code kan worden opgeslagen en gerepliceerd.
* eiwitten: Waterstofbindingen helpen de driedimensionale structuur van eiwitten te stabiliseren.
Belangrijke opmerking:
Hoewel de term "zwak" wordt gebruikt, zijn waterstofbindingen niet echt zwakke interacties. Ze zijn aanzienlijk sterker dan van der Waals -krachten maar zwakker dan covalente bindingen. Hun kracht is cruciaal voor veel biologische en chemische processen.
 Eigenschappen van staalsoorten
Eigenschappen van staalsoorten  Prehistorische bling? Esthetiek cruciale factor bij de ontwikkeling van de vroegste koperlegeringen
Prehistorische bling? Esthetiek cruciale factor bij de ontwikkeling van de vroegste koperlegeringen  Wat wordt bedoeld met een stof waarvan wordt beschreven dat deze een lage weerstand heeft?
Wat wordt bedoeld met een stof waarvan wordt beschreven dat deze een lage weerstand heeft?  Wat is de intermoleculaire kracht die wordt aangetroffen in waterstofsulfide?
Wat is de intermoleculaire kracht die wordt aangetroffen in waterstofsulfide?  Wat is van nature voorkomend solide anorganische verbinding of element?
Wat is van nature voorkomend solide anorganische verbinding of element?
 NASA berekende regenval op de Filipijnen van tropische storm Kai-Tak
NASA berekende regenval op de Filipijnen van tropische storm Kai-Tak Feiten over de Great Plains
Feiten over de Great Plains  Hoe koolstofintensieve industrieën koolstofrecycling kunnen opschalen
Hoe koolstofintensieve industrieën koolstofrecycling kunnen opschalen Hoe noem je mensen die bestuderen ruïnes?
Hoe noem je mensen die bestuderen ruïnes?  Wat Arizona en andere door droogte geteisterde staten kunnen leren van Israëls baanbrekende waterstrategie
Wat Arizona en andere door droogte geteisterde staten kunnen leren van Israëls baanbrekende waterstrategie
Hoofdlijnen
- Hoe een omgedraaid gen vlinders hielp mimicry te ontwikkelen
- Neutronen onthullen hoe het pancratistatine op kanker jaagt en gezonde cellen in stand houdt
- Wanneer wetenschapper DNA kopiëren, wat moeten ze eerst uitsnijden?
- Wat is een chromosoom?
- Hoe de circadiane cyclus de reactie op medicijnen in planten beïnvloedt
- Op welke basis bindt adenine in RNA?
- Welk type organisme wordt gebruikt om enzymen in huis en industrie te produceren?
- Waarom wordt colchicine gebruikt voor het bereiden van een metafasespread?
- Wat gebeurt er in ons lichaam tijdens celademhaling?
- Nieuwe methode kan leiden tot betere in vivo medicijnafgifte

- Video:Kan het mengen van huishoudelijke schoonmaakmiddelen je doden?

- Nieuwe methode voor het meten van interne spanningen voor lucht- en ruimtevaarttechniek

- Belangrijkste bewijsmateriaal dat hydrofobiciteit associeert met effectieve zuurkatalyse
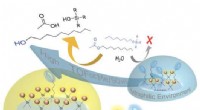
- Wetenschappers ontwerpen manier om onschadelijke bacteriën te gebruiken om zware metalen in drinkwater te detecteren

 Onderwatergeluid beïnvloedt de relaties van zeedieren. Maar in welke mate?
Onderwatergeluid beïnvloedt de relaties van zeedieren. Maar in welke mate?  Is een koekje samengesteld homogeen mengsel of heterogeen mengsel?
Is een koekje samengesteld homogeen mengsel of heterogeen mengsel?  Wat is bacteriële spore?
Wat is bacteriële spore?  Kan de massa van een planeet beïnvloeden hoeveel manen er zijn?
Kan de massa van een planeet beïnvloeden hoeveel manen er zijn?  Wanneer een buitenste deel van de ster explodeert, produceert het Super Nova?
Wanneer een buitenste deel van de ster explodeert, produceert het Super Nova?  Waarom zou je verwachten dat de kristallen in een opdringerige rots groter zijn dan extrusieve rots?
Waarom zou je verwachten dat de kristallen in een opdringerige rots groter zijn dan extrusieve rots?  Ogen in de lucht:hoe China's geavanceerde aardobservatiesysteem de mondiale vooruitgang vormgeeft
Ogen in de lucht:hoe China's geavanceerde aardobservatiesysteem de mondiale vooruitgang vormgeeft  AP legt uit:Hoe groot is een elektromagnetische aanval?
AP legt uit:Hoe groot is een elektromagnetische aanval?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

