
Wetenschap
Wat gebeurt er als een fluoratoom in chemische reactie wordt mei -ion wordt?
De basis
* fluoratoom: Een fluoratoom heeft 9 protonen en 9 elektronen. Het is zeer elektronegatief, wat betekent dat het een sterke aantrekkingskracht heeft op elektronen.
* fluoride -ion: Een fluoride -ion (F⁻) heeft een extra elektron gekregen, waardoor het 9 protonen en 10 elektronen heeft. Dit maakt het negatief opgeladen.
De chemische reactie
Wanneer een fluoratoom een fluoride -ion wordt, ondergaat het meestal een reductie reactie. Dit betekent dat het een elektron wint . Hier is een eenvoudig voorbeeld:
* Na (natrium) + F (fluor) → Na⁺ (natriumion) + F⁻ (fluoride -ion)
In deze reactie:
* natrium (na) verliest een elektron en wordt een positief geladen natriumion (NA⁺). Dit is een oxidatie reactie.
* fluor (f) wint dat elektron en wordt een negatief geladen fluoride -ion (F⁻). Dit is een reductie reactie.
Waarom gebeurt dit?
Fluor is zeer elektronegatief, wat betekent dat het een sterke wens heeft om zijn buitenste elektronenschaal te vullen (die 8 elektronen kan bevatten). Door een elektron te winnen, bereikt het een stabiele, edelgasconfiguratie, waardoor het stabieler wordt.
gevolgen van fluoridevorming
* ionische bindingen: Fluoride -ionen (F⁻) zijn cruciaal voor het vormen van ionische bindingen met andere elementen, vooral metalen. Dit resulteert in de vorming van zouten, zoals natriumfluoride (NAF).
* Oplosbaarheid: Fluoride -ionen zijn vaak oplosbaar in water, wat belangrijk is voor hun rol in verschillende processen.
* Biologische betekenis: Fluoride -ionen spelen een cruciale rol bij het voorkomen van tandbederf door het versterken van tandglazuur.
Laat het me weten als je meer details wilt over een specifiek aspect van fluor- of fluoride -ionengedrag!
 De chemische formule voor glucose is C6H12O6. Uit hoeveel verschillende elementen bestaat één molecuul glucose?
De chemische formule voor glucose is C6H12O6. Uit hoeveel verschillende elementen bestaat één molecuul glucose?  Het verborgen pad van perovskietvorming onthullen
Het verborgen pad van perovskietvorming onthullen Hoeveel atomen O zitten er in 3Na2SO4?
Hoeveel atomen O zitten er in 3Na2SO4?  Hoe zou je een oplosbaar zout maken van een onoplosbare basis?
Hoe zou je een oplosbaar zout maken van een onoplosbare basis?  Welke zwavel in een pure elementstatus wordt meestal in de buurt van actief gevonden?
Welke zwavel in een pure elementstatus wordt meestal in de buurt van actief gevonden?
 Klimaatprojecties laten minder kansen zien voor voorgeschreven branden
Klimaatprojecties laten minder kansen zien voor voorgeschreven branden  Wetenschappers zetten schadebeoordelingstool in bij hulpverlening in Laos
Wetenschappers zetten schadebeoordelingstool in bij hulpverlening in Laos Op het geboorteland van Siberië, olie neemt geen nee als antwoord
Op het geboorteland van Siberië, olie neemt geen nee als antwoord Omgeving die voldoet aan de behoeften van een organisme?
Omgeving die voldoet aan de behoeften van een organisme?  Nieuw onderzoek wijst uit dat het bosareaal per hoofd van de bevolking met meer dan 60% is afgenomen
Nieuw onderzoek wijst uit dat het bosareaal per hoofd van de bevolking met meer dan 60% is afgenomen
Hoofdlijnen
- Welke machine maakt kleine voren en zaait zaden erin?
- Aan welke regio van de operon bindt de repressor?
- Wat betekent de term alt in de wetenschap?
- Waarom groeit microben op voedsel?
- Wetenschappers vinden antarctische microben die alleen van lucht leven
- Wat zijn de grote speekselklier?
- Zijn voedingsmiddelen gemaakt met behulp van biotechnologie veilig om te eten?
- Wat zijn de drie belangrijkste soorten rna?
- Waarom hebben de 4 resulterende cellen van meiose geen chromosomen gekoppeld?
- Wetenschappers verduidelijken aspect van interacties tussen vaste stoffen en vloeistoffen in dunne film

- Wetenschappers ontwikkelen unieke polymeercoating om schadelijke schimmels aan te pakken
- Bedrieglijk eenvoudig proces kan de recycling van kunststoffen stimuleren

- Cement versus beton:hun verschillen, en kansen voor duurzaamheid

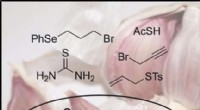
- Korte totale synthese van ajoen, een biologisch actieve component in olie-extracten van knoflook
 Wat is de edelgasnotatie van beryllium?
Wat is de edelgasnotatie van beryllium?  Video:Overstromingen in Queensland 2017
Video:Overstromingen in Queensland 2017 G7 gaat zich inzetten voor het verminderen van de plasticproductie:Frans ministerie
G7 gaat zich inzetten voor het verminderen van de plasticproductie:Frans ministerie  De piek van een berg in de buurt van de evenaar is het hele jaar door bedekt met sneeuw?
De piek van een berg in de buurt van de evenaar is het hele jaar door bedekt met sneeuw?  Neutronen onthullen de wilde Weyl-wereld van halfmetalen
Neutronen onthullen de wilde Weyl-wereld van halfmetalen Vissen op scholen kunnen het rustig aan doen
Vissen op scholen kunnen het rustig aan doen Materiaalwetenschappers leren hoe parelmoer wordt gemaakt
Materiaalwetenschappers leren hoe parelmoer wordt gemaakt Wat zijn 5 warmtegeleiders?
Wat zijn 5 warmtegeleiders?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

