
Wetenschap
Wat zijn waterstofbinding?
Waterstofbindingen:de lijm van het leven
Waterstofbindingen zijn een type zwakke chemische binding Dat speelt een cruciale rol in veel biologische processen. Ze zijn verantwoordelijk voor het bij elkaar houden van moleculen zoals water en eiwitten en beïnvloeden zelfs de structuur van DNA.
Hier is een uitsplitsing:
* wat ze zijn: Waterstofbindingen vormen zich tussen A waterstofatoom (H) dat is covalent gebonden aan een zeer elektronegatief atoom (zoals zuurstof, stikstof of fluor), en een eenzaam paar elektronen op een ander elektronegatief atoom.
* waarom ze vormen: Het elektronegatieve atoom trekt de gedeelde elektronen in de covalente binding aan, waardoor A gedeeltelijke positieve lading ontstaat Op het waterstofatoom en een gedeeltelijke negatieve lading op het elektronegatieve atoom. Dit verschil in lading creëert een aantrekkelijke kracht tussen de positief geladen waterstof en het negatief geladen eenzame paar.
* Kracht: Waterstofbindingen zijn zwakker dan covalente bindingen, maar sterker dan van der Waals krachten. Ze worden vaak beschreven als "plaknotities" die moleculen bij elkaar houden.
* Belang:
* Water: Waterstofbindingen zijn verantwoordelijk voor de unieke eigenschappen van het water, inclusief het hoge kookpunt, oppervlaktespanning en het vermogen om als oplosmiddel te fungeren.
* eiwitten: Waterstofbindingen helpen de driedimensionale structuur van eiwitten te behouden, wat essentieel is voor hun functie.
* DNA: Waterstofbindingen houden de twee DNA -strengen bij elkaar, waardoor genetische informatie wordt gekopieerd en overgedragen.
* Andere moleculen: Waterstofbindingen zijn ook belangrijk om koolhydraten, lipiden en andere biologische moleculen bij elkaar te houden.
In eenvoudige bewoordingen: Stel je een waterstofbinding voor als een kleine magneet die twee moleculen bij elkaar houdt. Het is niet zo sterk als een superlijmbinding, maar het is nog steeds belangrijk om dingen op hun plaats te houden.
Hier is een analogie: Denk aan een klaslokaal vol met studenten. De bureaus vertegenwoordigen moleculen en de studenten vertegenwoordigen de atomen binnen die moleculen. De waterstofbindingen zijn als de magneten die de bureaus bij elkaar houden, waardoor ze georganiseerd blijven en niet uit elkaar vallen.
 Wat is dialuminiumtrioxide?
Wat is dialuminiumtrioxide?  Nieuwe mechanismen ontdekt om luchtmoleculen te scheiden
Nieuwe mechanismen ontdekt om luchtmoleculen te scheiden Onderzoek daagt de heersende visie uit over hoe metaalorganische raamwerken gassen opslaan
Onderzoek daagt de heersende visie uit over hoe metaalorganische raamwerken gassen opslaan  Een neutraal atoom met 8 protonen moet dat hebben?
Een neutraal atoom met 8 protonen moet dat hebben?  Fluorescentiesonde toont de verdeling van actieve lithiumsoorten op lithiummetaalanoden
Fluorescentiesonde toont de verdeling van actieve lithiumsoorten op lithiummetaalanoden
 Mijten die vliegen & bijten
Mijten die vliegen & bijten  Tropische storm Ophelia verschijnt als een komma in NASA-beelden
Tropische storm Ophelia verschijnt als een komma in NASA-beelden De belangrijkste veranderingen in de luchtkwaliteit in het VK tijdens de lockdown waren in stedelijke gebieden, recensie bevestigt
De belangrijkste veranderingen in de luchtkwaliteit in het VK tijdens de lockdown waren in stedelijke gebieden, recensie bevestigt Hoe interageert de door de stad veroorzaakte opwarming in Beijing met de luchttemperatuur in de zomer?
Hoe interageert de door de stad veroorzaakte opwarming in Beijing met de luchttemperatuur in de zomer? Wat is de betekenis van studiewetenschap voor de samenleving?
Wat is de betekenis van studiewetenschap voor de samenleving?
Hoofdlijnen
- Informatie die een eigenschap specificeert, is gecodeerd in genen of stukjes DNA die zich op de chromosomen bevinden. De passage van deze instructies van de ene generatie naar de volgende g?
- Welke cellen vervullen dezelfde functie?
- Hoe worden genen aan- en uitgezet?
- Er is een gemakkelijke manier om mitose en meiose te begrijpen
- Zijn genderverschillen vooraf bepaald?
- Waarom zijn er geen hyena's in Europa?
- Studie:Hoe placenta's evolueerden bij zoogdieren
- Habitat telt wanneer roofdieren op de loer liggen
- Wetenschappers onthullen waarom buikwantsen zo goed door je darmen kunnen zwemmen
- Efficiëntere fotokatalysatoren kunnen het potentieel van zonne-energie ontsluiten

- De tijd is rijp! Een innovatieve contactloze methode voor het tijdig oogsten van zachtfruit
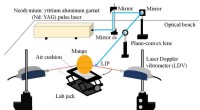
- Zwak gebonden zout is een belangrijk ingrediënt voor zeer zuivere Li@C60-film

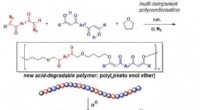
- Nieuw synthetisch polymeer afbreekbaar onder zeer milde zure omstandigheden
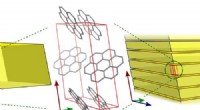
- Fluorescerend kristal mysterie opgelost
 Ben je blij dat je gestemd hebt, of niet?
Ben je blij dat je gestemd hebt, of niet?  Een waterfilter maken met zand en stenen
Een waterfilter maken met zand en stenen  Wat is een levenscyclus waarin organismen heen en weer schakelen tussen diploïde haploïde stadia?
Wat is een levenscyclus waarin organismen heen en weer schakelen tussen diploïde haploïde stadia?  Bedreiging voor Florida neemt af, aangezien Isaias naar verwachting een tropische storm zal blijven
Bedreiging voor Florida neemt af, aangezien Isaias naar verwachting een tropische storm zal blijven Kunnen creativiteit en innovatie worden aangeleerd? Een nieuwe gratis online cursus zegt 'ja'
Kunnen creativiteit en innovatie worden aangeleerd? Een nieuwe gratis online cursus zegt 'ja'  Hoe is grond gerelateerd aan de verwering en erosie van rotsen?
Hoe is grond gerelateerd aan de verwering en erosie van rotsen?  Welke golven zijn mechanisch?
Welke golven zijn mechanisch?  Wat beschrijft hoe snel een object wordt beweegt, gemeten door zijn tijd en afstand?
Wat beschrijft hoe snel een object wordt beweegt, gemeten door zijn tijd en afstand?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

