
Wetenschap
Wat gebeurt er als koperionoplossing wordt gecombineerd met lithiumoplossing?
Hier is de uitsplitsing:
* koperionen (cu 2+
* lithium -ionen (li + ) zijn gemakkelijker geoxideerd (verlies elektronen) dan koperionen (Cu 2+ ).
De reactievergelijking:
Cu
2+
(aq) + 2LI (s) → cu (s) + 2li
+
(aq)
Verklaring:
* koperionen (cu
2+
) Verkrijg twee elektronen uit het lithiummetaal en wordt koperen metaal (Cu) .
* lithiummetaal (li) verliest een elektron, wordt lithiumionen (li
+
) .
Observaties:
* roodbruine koperen metaal zal uit de oplossing neerslaan.
* De oplossing zal van kleur veranderen, afhankelijk van de concentratie van de resterende ionen.
Belangrijke opmerking: Deze reactie is zeer exotherme , wat betekent dat het veel warmte vrijgeeft. Het kan behoorlijk krachtig zijn, dus het moet voorzichtig worden uitgevoerd in een gecontroleerde omgeving.
Aanvullende informatie:
* Dit type reactie staat bekend als een verplaatsingsreactie , waarbij een meer reactief metaal (lithium) een minder reactief metaal (koper) van zijn oplossing verplaatsen.
* De reactiviteit van metalen wordt bepaald door hun standaardreductiepotentieel . Lithium heeft een veel lager reductiepotentieel dan koper, wat aangeeft dat het waarschijnlijker is om elektronen te verliezen en te worden geoxideerd.
 Nieuwe techniek kan helpen bij het ontwerpen van vervuild waterfilter, menselijke weefsels
Nieuwe techniek kan helpen bij het ontwerpen van vervuild waterfilter, menselijke weefsels Noem de fundamentele hoeveelheden en hun bijbehorende eenheid?
Noem de fundamentele hoeveelheden en hun bijbehorende eenheid?  Hoe wordt een verbinding genoemd als het ionische bindingen heeft?
Hoe wordt een verbinding genoemd als het ionische bindingen heeft?  Noem twee processen die worden gebruikt om mengsels te scheiden?
Noem twee processen die worden gebruikt om mengsels te scheiden?  Verhouden moleculen bij lagere temperaturen sneller dan die hogere temperatuur?
Verhouden moleculen bij lagere temperaturen sneller dan die hogere temperatuur?
 Astronomen creëren 40% meer CO2-uitstoot dan de gemiddelde Australiër. Hier is hoe ze kunnen verbeteren
Astronomen creëren 40% meer CO2-uitstoot dan de gemiddelde Australiër. Hier is hoe ze kunnen verbeteren Beschrijf het Green House -effect en op het klimaat?
Beschrijf het Green House -effect en op het klimaat?  Hoe biologische afbreekadditieven werken
Hoe biologische afbreekadditieven werken  NASA-NOAA-satelliet analyseert een versterkende tyfoon Kammuri
NASA-NOAA-satelliet analyseert een versterkende tyfoon Kammuri Opwarming van de aarde zorgt voor een aanzienlijke toename van het overstromingsrisico voor Centraal- en West-Europa
Opwarming van de aarde zorgt voor een aanzienlijke toename van het overstromingsrisico voor Centraal- en West-Europa
Hoofdlijnen
- Tagging-project werpt licht op de ongrijpbare witte haai
- Wat is de vorm van kern in een plantencel?
- Hoe voorkomen planten zelfbevruchting?
- Wat is een voorbeeld van orgaansystemen waarvan de anatomische kenmerken volledig verschillen in functie gevonden zoogdieren dan hun niet-zoogdier voorouders?
- De effectiviteit van camouflage bij verschillende dieren vergelijken
- Wat zijn fotoblastische cellen?
- Is het levend of dood? Team laat zien hoe je de thermische handtekeningen van afzonderlijke cellen kunt meten
- Hoeveel menselijke chromosomen zijn zowel voor mannen als vrouwen gemeenschappelijk?
- Pesticiden en slechte voeding schaden de diergezondheid
- Onderzoek wijst op tweede kans voor afgewezen antibioticumkandidaat

- Een diepe duik in het belangrijkste COVID-19-eiwit is een stap in de richting van nieuwe medicijnen, vaccins
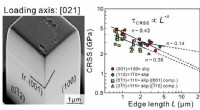
- Micropijlercompressie voor het vinden van hittebestendige legeringen
- Biocompatibel binair hologram met mogelijkheden voor medicijnelutie

- Chiraliteit in realtime
 Wat zijn de verschillen tussen zon en maan?
Wat zijn de verschillen tussen zon en maan?  Is het waar dat in een watermolecuul de elektronen binnenin meer aangetrokken worden tot waterstofatomen?
Is het waar dat in een watermolecuul de elektronen binnenin meer aangetrokken worden tot waterstofatomen?  Ideeën voor celademhaling
Ideeën voor celademhaling Oostenrijk slaagt er niet in om buurlanden voor zich te winnen voor nucleaire uitfasering
Oostenrijk slaagt er niet in om buurlanden voor zich te winnen voor nucleaire uitfasering Is chlorofyl een term van de membranen chloroplasten?
Is chlorofyl een term van de membranen chloroplasten?  Wat is chemische vervuiling?
Wat is chemische vervuiling?  Wat is het verschil tussen STARS AD -sateliet?
Wat is het verschil tussen STARS AD -sateliet?  Het oplossen van mysteries van metallisch glas op nanoschaal
Het oplossen van mysteries van metallisch glas op nanoschaal
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

