
Wetenschap
Waarom leidt waterstofchloride geen elektriciteit wanneer opgelost in hexaan maar electiciteit water leidt?
Waarom HCL elektriciteit in water geleidt:
* ionisatie: Wanneer HCL oplost in water, ondergaat het ionisatie. Dit betekent dat de HCL-moleculen uit elkaar breken in waterstofionen (H+) en chloride-ionen (Cl-). Deze ionen zijn vrij om door de oplossing te bewegen.
* Laad dragers: De aanwezigheid van deze mobiele, geladen ionen zorgt voor de stroom van elektriciteit. Wanneer een elektrische potentiaal wordt toegepast, bewegen de positieve waterstofionen naar de negatieve elektrode en bewegen de negatieve chloride -ionen naar de positieve elektrode, waardoor een elektrisch circuit wordt voltooid.
Waarom HCl geen elektriciteit in hexaan leidt:
* Niet-polair oplosmiddel: Hexane is een niet-polair oplosmiddel. Dit betekent dat het geen significante scheiding van lading binnen zijn moleculen heeft. Het trekt de HCL -moleculen niet sterk genoeg aan om ze te laten ioniseren.
* Geen gratis ionen: Omdat HCL niet ioniseert in hexaan, zijn er geen gratis ionen om een elektrische stroom te dragen. De oplossing blijft elektrisch neutraal.
Samenvattend:
Het belangrijkste verschil ligt in het vermogen van het oplosmiddel om de HCL -moleculen uit elkaar te breken en vrije ionen te vormen. Water, een polair oplosmiddel, bevordert ionisatie, terwijl hexaan, niet-polair zijn, dat niet doet.
 Zijn fysieke eigenschappen van waterstofperoxide behalve?
Zijn fysieke eigenschappen van waterstofperoxide behalve?  Wat zijn opgeloste kaas opgeloste kaas?
Wat zijn opgeloste kaas opgeloste kaas?  Welk proces verandert van gas in vaste stof?
Welk proces verandert van gas in vaste stof?  Chemici leren neurale netwerken om eigenschappen van verbindingen te voorspellen
Chemici leren neurale netwerken om eigenschappen van verbindingen te voorspellen Surface-enhanced Raman-spectroscopiemethode realiseert kwantitatieve detectie van geneesmiddelen tegen kanker in serum
Surface-enhanced Raman-spectroscopiemethode realiseert kwantitatieve detectie van geneesmiddelen tegen kanker in serum
 2018 begint met recordkou in delen van het Midwesten
2018 begint met recordkou in delen van het Midwesten Nieuwe nachtverlichtingskaarten openen mogelijke realtime toepassingen
Nieuwe nachtverlichtingskaarten openen mogelijke realtime toepassingen Om de landbouw klimaatvriendelijker te maken, koolstoflandbouw heeft duidelijke regels nodig
Om de landbouw klimaatvriendelijker te maken, koolstoflandbouw heeft duidelijke regels nodig De website 'Understanding Science' maakt duidelijk wat wetenschap is en niet
De website 'Understanding Science' maakt duidelijk wat wetenschap is en niet  Hoe Twitter – nu X – helpt bij het begrijpen van de Canadese waarden en houding ten opzichte van asielzoekers
Hoe Twitter – nu X – helpt bij het begrijpen van de Canadese waarden en houding ten opzichte van asielzoekers
Hoofdlijnen
- Transcriptie en translatie Zijn de twee processen die nodig zijn om RNA -eiwit -DNA -eiwit te veranderen?
- Barrières overschrijden:hoe het konijnenvirus myxoma in een nieuwe soort sprong
- Waarom gebruik je ijskoude toestand in de cellysis?
- Hoe verschillen algen van andere planten?
- Oude microben bieden aanwijzingen voor hoe complex het leven is geëvolueerd
- Hoe gebruik ik de wetenschappelijke methode buiten mijn klaslokaal?
- Hoe maak je een plantencelmodel op stap-voor-stap
- Wat zijn de drie redenen waarom celdeling moet plaatsvinden?
- Hoe verhindert de afwezigheid van een nucleaire envelop in prokaryoten de controle van genexpressie door RNA na transcriptie te modificeren?
- Nieuw niet-radioactief, neutraal reagens onthult virussen in duidelijke details
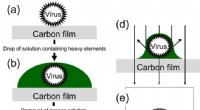
- Onderzoekers ontwikkelen micro-organismen om vervuiling door PET-plastic aan te pakken
- Onderzoek onthult inzichten in enzym dat een algemeen broeikasgas bestrijdt

- Chemici versnelden de reactie van vinylsulfiden 10 keer
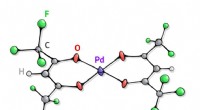
- Chemici gebruiken elektrochemie om de productie van medicijnen te versterken

 Heb je ooit een planeet een naam willen geven? Hier is hoe er één werd gevonden door de James Webb-telescoop
Heb je ooit een planeet een naam willen geven? Hier is hoe er één werd gevonden door de James Webb-telescoop  Wat zijn de deeltjes in kern van alle atomen?
Wat zijn de deeltjes in kern van alle atomen?  Ouderbetrokkenheid speelt een sleutelrol in de academische prestaties van kinderen, uit onderzoek blijkt
Ouderbetrokkenheid speelt een sleutelrol in de academische prestaties van kinderen, uit onderzoek blijkt Hoe patronen in de natuur ontstaan en alles inspireren, van wetenschappelijke theorie tot biologisch afbreekbare materialen
Hoe patronen in de natuur ontstaan en alles inspireren, van wetenschappelijke theorie tot biologisch afbreekbare materialen Waar is een kopernugget van gemaakt?
Waar is een kopernugget van gemaakt?  Zieke Franse luchtvaartmaatschappij XL staakt vluchten vanwege dreigend faillissement
Zieke Franse luchtvaartmaatschappij XL staakt vluchten vanwege dreigend faillissement Onderzoekers openen een pad naar kwantumcomputing in reële omstandigheden
Onderzoekers openen een pad naar kwantumcomputing in reële omstandigheden Wat zijn niet -reactieve gassen?
Wat zijn niet -reactieve gassen?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

