
Wetenschap
Heeft een koolwaterstof met grote moleculen een hoger kookpunt dat één kleine moleculen?
* intermoleculaire krachten: De primaire krachten die koolwaterstofmoleculen bij elkaar houden, zijn van der Waals Forces . Deze krachten zijn zwak, maar ze nemen in sterkte toe naarmate de grootte van het molecuul toeneemt. Grotere moleculen hebben meer oppervlakte en meer elektronen, wat leidt tot sterkere van der Waals -attracties.
* Meer energie vereist voor verdamping: Om een vloeistof te koken, moet u voldoende energie leveren om de intermoleculaire krachten te overwinnen die de moleculen bij elkaar houden. Omdat grotere koolwaterstoffen sterkere intermoleculaire krachten hebben, vereist het meer energie (en dus een hogere temperatuur) om ze uit elkaar te breken en over te gaan naar de gasvormige toestand.
Voorbeeld:
* Butane (C4H10): Een kleine koolwaterstof met een kookpunt van -0,5 ° C.
* Decane (C10H22): Een grotere koolwaterstof met een kookpunt van 174 ° C.
Opmerking: De relatie tussen moleculaire grootte en kookpunt is niet altijd eenvoudig. Andere factoren, zoals vertakking in het molecuul, kunnen kookpunten beïnvloeden. Over het algemeen hebben grotere koolwaterstofmoleculen echter meestal hogere kookpunten dan kleinere.
 Verouderde uitkijktorens zijn nog steeds belangrijk tijdens het brandseizoen in het westen van de VS
Verouderde uitkijktorens zijn nog steeds belangrijk tijdens het brandseizoen in het westen van de VS Studie laat zien hoe een klein zeedier zichzelf en de oceaan voedt
Studie laat zien hoe een klein zeedier zichzelf en de oceaan voedt Hoe wordt de wetenschap gebruikt om tornado's te begrijpen?
Hoe wordt de wetenschap gebruikt om tornado's te begrijpen?  Wat is de kleinste staat in de VS? Kijkend naar oppervlakte en bevolking
Wat is de kleinste staat in de VS? Kijkend naar oppervlakte en bevolking  Kwikniveaus in Hawaiiaans grootoog, geelvintonijn rijzend
Kwikniveaus in Hawaiiaans grootoog, geelvintonijn rijzend
Hoofdlijnen
- Wondgenezing of regeneratie - de omgeving beslist?
- Wat doet een kern in eukaryotische cel?
- Wie werd gecrediteerd voor het ontwikkelen van de tak van de biologie die nu genetica wordt genoemd?
- Onthulling van natuurbeheerders:studie benadrukt de cruciale rol van aaseters in wetlands
- Wat wordt bedoeld met morfologische diversiteit?
- CRISPR belooft antimicrobiële resistentie aan te pakken, maar bacteriën kunnen terugvechten
- Waarom verschilt de kleur van twee groepencellen?
- Zeeschildpadden keren terug, maar wat zijn de effecten op kustecosystemen?
- Welk koninkrijk bevat eencellige organisims met een echte kern?
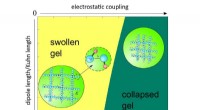
- Onderzoekers ontwikkelen microscopische theorie van polymeergel
- Een nieuw soort vaccin op basis van spinrag
- Gemanipuleerde microben kunnen biologisch afbreekbare kunststoffen produceren tegen lagere kosten en milieu-impact dan plantaardige kunststoffen

- Dankzij de techniek voor het bewerken van genen kunnen zijderupsen spinnenzijde produceren

- Een onbreekbare combinatie van onzichtbare inkt en kunstmatige intelligentie

 Hoe geeft de massa van een object invloed op de energie die nodig is om het te verwarmen, het geeft ook een voorbeeld.
Hoe geeft de massa van een object invloed op de energie die nodig is om het te verwarmen, het geeft ook een voorbeeld.  Welk percentage energie gaat verloren als hitte?
Welk percentage energie gaat verloren als hitte?  1.50 mol H3PO4 heeft hoeveel atomen P?
1.50 mol H3PO4 heeft hoeveel atomen P?  Wat is de term voor het vermogen van een organisme om te overleven en zich voort te planten?
Wat is de term voor het vermogen van een organisme om te overleven en zich voort te planten?  Wat is het tijdperk van het universum volgens Hubble Telescope?
Wat is het tijdperk van het universum volgens Hubble Telescope?  Is vloeibaar potentieel of kinetische energie?
Is vloeibaar potentieel of kinetische energie?  Hoe kunnen tektonische platen het oppervlak vormen?
Hoe kunnen tektonische platen het oppervlak vormen?  Hoe je het geschenkstelende spel Bad Santa kunt winnen, volgens een wiskundige
Hoe je het geschenkstelende spel Bad Santa kunt winnen, volgens een wiskundige
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

