
Wetenschap
Wat zijn zure oxiden?
Zure oxiden:een snel overzicht
Zure oxiden zijn binaire verbindingen Met zuurstof en ten minste één ander element, waarbij het andere element meer elektronegatief is dan zuurstof . Het zijn meestal niet-metalen oxiden en reageer met water om zuren te vormen .
Key -kenmerken van zure oxiden:
* Niet-metalen aard: De meeste zure oxiden worden gevormd door niet-metalen zoals zwavel, fosfor, chloor en koolstof.
* reactie met water: Ze reageren met water om zuren te vormen. Zwaveltrioxide (SO₃) reageert bijvoorbeeld met water om zwavelzuur te vormen (H₂so₄).
* reactie met basen: Ze reageren met bases om zouten en water te vormen. Koolstofdioxide (CO₂) reageert bijvoorbeeld met natriumhydroxide (NaOH) om natriumcarbonaat (Na₂co₃) en water (H₂o) te vormen.
* pH minder dan 7: Oplossingen van zure oxiden in water zijn zuur en hebben een pH minder dan 7.
Voorbeelden van zure oxiden:
* koolstofdioxide (co₂): Vormt koolzuur (H₂co₃) in water.
* zwaveldioxide (So₂): Vormt zwavelzuur (H₂so₃) in water.
* zwaveltrioxide (So₃): Vormt zwavelzuur (h₂so₄) in water.
* stikstofdioxide (no₂): Vormt salpeterzuur (HNO₃) in water.
* fosfor pentoxide (p₂o₅): Vormt fosforzuur (H₃PO₄) in water.
Opmerking: Sommige oxiden kunnen zowel zure als basic werken, afhankelijk van de reactieomstandigheden, deze worden amfoterische oxiden genoemd . Aluminiumoxide (al₂o₃) kan bijvoorbeeld werken als een zuur oxide bij het reageren met een sterke basis en als basisoxide bij het reageren met een sterk zuur.
Toepassingen van zure oxiden:
* Industriële productie van zuren: Zure oxiden worden gebruikt bij de industriële productie van verschillende zuren.
* Productie van meststoffen: Fosforzuur, geproduceerd uit fosfor pentoxide, is een belangrijk ingrediënt bij meststoffen.
* Productie van wasmiddelen: Zwavelzuur, geproduceerd uit zwaveltrioxide, wordt gebruikt bij de productie van wasmiddelen.
* Voedselproductie: Koolstofdioxide wordt gebruikt bij de productie van koolzuurhoudende dranken en als een rijsmiddel bij het bakken.
Inzicht in zure oxiden helpt ons om verschillende chemische reacties en hun toepassingen op verschillende gebieden te begrijpen.
 Wat is een zuivere condensator?
Wat is een zuivere condensator?  Nieuwe gedeeltelijke isovalente inductiestrategie voor anionsubstitutie om infrarood niet-lineaire optische materialen te ontwerpen
Nieuwe gedeeltelijke isovalente inductiestrategie voor anionsubstitutie om infrarood niet-lineaire optische materialen te ontwerpen Wat is het pH-getal van natriumhydroxide?
Wat is het pH-getal van natriumhydroxide?  Welke oplosmiddelen worden gebruikt om kaneelaldehyde op te lossen?
Welke oplosmiddelen worden gebruikt om kaneelaldehyde op te lossen?  Wat is PQ, PC en FD in fotosynthese?
Wat is PQ, PC en FD in fotosynthese?
 NASA ziet orkaan Irmas langs de kust van Cuba
NASA ziet orkaan Irmas langs de kust van Cuba Stalagmieten uit de Iraanse grot voorspellen een grimmige toekomst voor het klimaat in het Midden-Oosten
Stalagmieten uit de Iraanse grot voorspellen een grimmige toekomst voor het klimaat in het Midden-Oosten Wat is het wetenschappelijke verschil tussen warm weer en koud weer?
Wat is het wetenschappelijke verschil tussen warm weer en koud weer?  Een nieuwe hoop:GEDI levert een 3D-koolstofkaart van het bos op
Een nieuwe hoop:GEDI levert een 3D-koolstofkaart van het bos op Analyse van seismische patronen om de omvang van de grootste naschokken van aardbevingen te voorspellen
Analyse van seismische patronen om de omvang van de grootste naschokken van aardbevingen te voorspellen
Hoofdlijnen
- Hoe is make -up gekoppeld aan de wetenschap?
- Wat is de voortbeweging van een Euglena?
- Wat u moet weten over mitose voor een test
- Geef 10 ziekten veroorzaakt door bacteriën?
- Hoe de meningen van boeren het succes van strategieën voor de bestrijding van plantenziekten bepalen
- Welk lichaamssysteem behoort cerebellum?
- Waarom zijn schimmels niet groen?
- Welke activiteit zou de coördinatie van beide hersenen van de hemisferen vereisen?
- Gelabelde delen van een lintworm
- Verrassende ontdekking van celdood biedt aanwijzingen voor geboorteafwijkingen

- Nieuwe MOF is potentiële next-gen halfgeleider
- Materialen op een nieuwe manier maken door 3D-printbacteriën
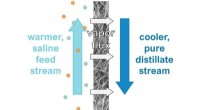
- Hoe maak je zout water beter schoon? Door ontziltingsgereedschappen droog te houden
- Gebruik van nabij-infrarood licht om een oor in het lichaam in 3D te printen

 Wat is een breuk in rots langs welke beweging plaatsvindt?
Wat is een breuk in rots langs welke beweging plaatsvindt?  Als de snelheid constant is, betekent dat dan geen verandering in momentum?
Als de snelheid constant is, betekent dat dan geen verandering in momentum?  Wat is een atoomnummer gelijk aan?
Wat is een atoomnummer gelijk aan?  Is er een fundamenteel deeltje in een elektron?
Is er een fundamenteel deeltje in een elektron?  Noodopstijging van oceaanmissies veroorzaakt door motorbrand
Noodopstijging van oceaanmissies veroorzaakt door motorbrand Onvermijdelijke aandoening gebruikt om nanolaser te bouwen
Onvermijdelijke aandoening gebruikt om nanolaser te bouwen De energiebron voor de meeste autotrofen is een water of B de zon C heterotrofen D andere autotrofen?
De energiebron voor de meeste autotrofen is een water of B de zon C heterotrofen D andere autotrofen?  Voorzorgsmaatregelen bij het kijken naar zonsverduistering?
Voorzorgsmaatregelen bij het kijken naar zonsverduistering?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

