
Wetenschap
Wat is een ionische band?
Wat is elektronegativiteit?
Elektronegativiteit is het vermogen van een atoom om elektronen aan te trekken in een chemische binding. Zie het als een "touwtrekken" tussen atomen.
Hoe ionische bindingen vormen:
1. overdracht van elektronen: In een ionische binding "verliest" één atoom (meestal een metaal) een of meer elektronen, en wordt een positief geladen ion (kation). Het andere atoom (meestal een niet -metaal) "wint" deze elektronen en wordt een negatief geladen ion (anion).
2. Elektrostatische aantrekkingskracht: De tegengesteld geladen ionen trekken elkaar sterk aan vanwege elektrostatische krachten, waardoor de ionische binding wordt gevormd.
Belangrijke kenmerken van ionische bindingen:
* Hoog smelten- en kookpunten: De sterke elektrostatische krachten vereisen veel energie om te breken.
* meestal vast bij kamertemperatuur: De rigide structuur gevormd door de ionen is moeilijk te verstoren.
* Goede elektriciteitsgeleiders in gesmolten of opgeloste toestanden: Wanneer gesmolten of opgelost, worden de ionen vrij om te bewegen, waardoor ze elektriciteit kunnen leiden.
* Over het algemeen oplosbaar in polaire oplosmiddelen zoals water: De polaire aard van water kan interageren met de geladen ionen, het verbreken van de ionische bindingen en het oplossen van de verbinding.
Voorbeeld:
Natriumchloride (NaCl), gemeenschappelijk tafelzout, is een voorbeeld van een ionische verbinding. Natrium (NA) verliest een elektron om Na+te worden, terwijl chloor (CL) een elektron krijgt om Cl- te worden. Deze tegengesteld geladen ionen worden vervolgens tot elkaar aangetrokken en vormen de ionische binding.
Samenvattend:
Ionische bindingen vormen zich tussen atomen met een groot elektronegativiteitsverschil, wat resulteert in een overdracht van elektronen, de vorming van tegengesteld geladen ionen en een sterke elektrostatische aantrekkingskracht daartussen. Dit leidt tot verbindingen met karakteristieke eigenschappen zoals hoge smeltpunten en goede elektrische geleidbaarheid wanneer ze worden gesmolten of opgelost.
 De beste manier om klimaatverandering tegen te gaan? Plant een biljoen bomen
De beste manier om klimaatverandering tegen te gaan? Plant een biljoen bomen Een graslandecosysteemproject in een schoenendoos doen
Een graslandecosysteemproject in een schoenendoos doen Hoe werkt een nepuil om vogels weg te jagen?
Hoe werkt een nepuil om vogels weg te jagen?  Wat maakt dat een Airbnb-host betrouwbaar lijkt voor potentiële huurders?
Wat maakt dat een Airbnb-host betrouwbaar lijkt voor potentiële huurders?  Werelds transitie naar schone energie te traag:IEA
Werelds transitie naar schone energie te traag:IEA
Hoofdlijnen
- De membraanreceptoren zijn eiwitten die zouden worden gesynthetiseerd op ribosomen waar?
- Welke kenmerken hebben alle prokaryoten gemeen?
- Zijn mannelijke Y-chromosomen korter dan X-chromosomen?
- Welk gevoel kan gemakkelijk worden gebruikt om de aanwezigheid van gist op kweekplaat te bepalen?
- Welk nut heeft het om een soort groeipatroon te weten op een agar -inslag of een bouillon medium organisme?
- De richting van synthese is een RNA -transcript?
- AI ontcijfert nieuwe genregulerende code in planten en maakt nauwkeurige voorspellingen voor nieuw gesequenced genomen
- Voedingsgedrag kan een indicator zijn van voerefficiëntie bij Holstein-koeien
- Wat zijn de 5 typen voor evolutie?
- Hoe moleculaire riboswitches werken in bacteriën
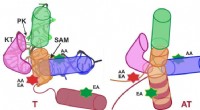
- Polymeer afgeleid van materiaal in de schelpen van garnalen kan geneesmiddelen tegen kanker afleveren op tumorplaatsen
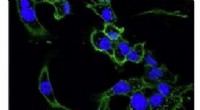
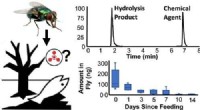
- Blaasvliegen kunnen worden gebruikt om het gebruik van chemische wapens en andere verontreinigende stoffen te detecteren
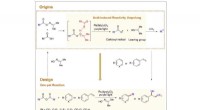
- Efficiënte methode voor fotokatalytische fluoralkyleringen van (hetero)arenen
- Video:Waarom plastic flessen worden gerecycled tot kleding

 Dan past een kracht van 92 N toe op zware doos door touw te gebruiken die in een hoek 45 graden wordt gehouden met de horizontale. Wat zijn verticale en horizontale componenten 92-N-kracht?
Dan past een kracht van 92 N toe op zware doos door touw te gebruiken die in een hoek 45 graden wordt gehouden met de horizontale. Wat zijn verticale en horizontale componenten 92-N-kracht?  Wat zijn de beste levensomstandigheden? Het verkennen van het multiversum kan ons helpen erachter te komen
Wat zijn de beste levensomstandigheden? Het verkennen van het multiversum kan ons helpen erachter te komen  Fotochrome bismutcomplexen zijn veelbelovend voor optische geheugenelementen
Fotochrome bismutcomplexen zijn veelbelovend voor optische geheugenelementen Wat is het verschil tussen een bacteriële en virale infectie?
Wat is het verschil tussen een bacteriële en virale infectie?  iPhone 11:wat u kunt verwachten en waarom wachten wellicht de beste optie is
iPhone 11:wat u kunt verwachten en waarom wachten wellicht de beste optie is  Hoe een potentiometer te testen
Hoe een potentiometer te testen Wat is de naam van drie Define Elements Electricity?
Wat is de naam van drie Define Elements Electricity?  Zieke zeezoogdieren duiken massaal op op de stranden van Californië
Zieke zeezoogdieren duiken massaal op op de stranden van Californië
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

