
Wetenschap
Is waterstoffosfaat een polair molecuul?
* Asymmetrische vorm: Het fosfaation (po₄³⁻) heeft een tetraëdrische vorm met vier zuurstofatomen rond het fosforatoom. De toevoeging van een waterstofatoom aan een van de zuurstofatomen introduceert een asymmetrie aan het molecuul.
* Elektronegativiteitsverschil: Zuurstof is elektronegatiefer dan zowel fosfor als waterstof. Dit betekent dat de zuurstofatomen elektronendichtheid wegtrekken van de fosfor- en waterstofatomen, waardoor gedeeltelijke negatieve ladingen ontstaan op de zuurstofatomen en gedeeltelijke positieve ladingen op de fosfor- en waterstofatomen.
* Dipoolmoment: De ongelijke verdeling van elektronendichtheid resulteert in een netto dipoolmoment, waardoor het molecuul polair wordt.
Daarom wordt waterstoffosfaat vanwege de asymmetrische vorm en de aanwezigheid van polaire bindingen beschouwd als een polair molecuul.
 Wat is de chemische verandering als een stof zijn glans verliest?
Wat is de chemische verandering als een stof zijn glans verliest?  Wat is de temperatuur van smeltpunt?
Wat is de temperatuur van smeltpunt?  Hoe beïnvloedt het mengen van een vaste stof en vloeistof de totale mengmassa?
Hoe beïnvloedt het mengen van een vaste stof en vloeistof de totale mengmassa?  Automatische aanmaak van databases voor materiaalontdekking:innovatie uit frustratie
Automatische aanmaak van databases voor materiaalontdekking:innovatie uit frustratie Hoe beïnvloeden antibiotica de eiwitsynthese?
Hoe beïnvloeden antibiotica de eiwitsynthese?
 Schudden, geen schade bij aardbeving in San Francisco Bay Area
Schudden, geen schade bij aardbeving in San Francisco Bay Area Ontwikkeling bedreigt tropische bossen, onderzoekers zeggen:
Ontwikkeling bedreigt tropische bossen, onderzoekers zeggen: Bacteriën die worden gebruikt om met diesel vervuilde grond in Groenland schoon te maken
Bacteriën die worden gebruikt om met diesel vervuilde grond in Groenland schoon te maken Milieukansen benutten onder een presidentschap van Trump
Milieukansen benutten onder een presidentschap van Trump Is orkaan Harvey een voorbode voor de toekomst van Houston?
Is orkaan Harvey een voorbode voor de toekomst van Houston?
Hoofdlijnen
- Kunnen hormonen worden uitgescheiden als reactie op externe stimuli?
- Welke genetische stoornis kan worden bestuurd door dieet?
- Wat zijn enkele voor- en nadelen van het gebruik van DNA-analyse om wetshandhaving bij misdrijven te ondersteunen?
- Plasmacellen ontwikkelen zich uit getransformeerde B- of T -cellen?
- Wie heeft er baat bij menselijke experimenten?
- Hersenonderzoek:Zingende muizen vertonen tekenen van leren
- Wat zijn de kleine systeemorganen?
- Welke zijn meer geconserveerde DNA- of eiwitsequentie?
- Hoe orchideeën werken
- Moleculair baken signaleert lage zuurstof met ultrageluid

- De vorm van zachte materie veranderen met behulp van logische circuits gemaakt van DNA
- Praktische oplossing voor het voorkomen van corrosieve opbouw in nucleaire systemen

- Een intelligent zacht materiaal dat krult onder druk of uitzet wanneer het wordt uitgerekt

- Dynamische evolutie van aluminiumcoördinatieomgevingen in mordenietzeoliet
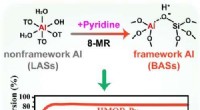
 Welke vouwt in de korstvorm meestal?
Welke vouwt in de korstvorm meestal?  Mijn March Madness Bracket is Busted. Maar zo is Pretty Much Everyone Elses
Mijn March Madness Bracket is Busted. Maar zo is Pretty Much Everyone Elses  Wat is olie boren?
Wat is olie boren?  Welk type fout vormt geen bergen?
Welk type fout vormt geen bergen?  Wat is de formule voor ammonium astatide?
Wat is de formule voor ammonium astatide?  Wat zijn voorbeelden van Sols?
Wat zijn voorbeelden van Sols?  Een snellere camera met één pixel:nieuwe techniek vermindert het aantal opnamen dat nodig is voor lensloze beeldvorming aanzienlijk
Een snellere camera met één pixel:nieuwe techniek vermindert het aantal opnamen dat nodig is voor lensloze beeldvorming aanzienlijk Welk type binding heeft nikkelchloride?
Welk type binding heeft nikkelchloride?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

