
Wetenschap
Beschrijf de stappen bij het schrijven van een evenwichtige chemische vergelijking?
1. Schrijf de ongebalanceerde vergelijking
* Identificeer de reactanten en producten: Deze informatie wordt meestal aan u gegeven in het probleem, of u kunt deze afleiden op basis van de reactiebeschrijving.
* Schrijf de chemische formules: Gebruik de juiste chemische formules voor elke reactant en product. Vergeet niet om subscripts te gebruiken om het aantal atomen in elk molecuul weer te geven.
Voorbeeld:
* Woordvergelijking: Waterstofgas reageert met zuurstofgas om water te produceren.
* ongebalanceerde vergelijking: H₂ + O₂ → H₂o
2. Tel atomen aan elke kant
* Reactant -zijde: Tel het aantal atomen van elk element aanwezig in de reactanten.
* productzijde: Tel het aantal atomen van elk element dat in de producten aanwezig is.
Voorbeeld:
* Reactantzijde:2 waterstofatomen (H₂), 2 zuurstofatomen (O₂)
* Productzijde:2 waterstofatomen (H₂o), 1 zuurstofatoom (H₂o)
3. Breng de vergelijking in evenwicht
* Coëfficiënten aanpassen: Coëfficiënten zijn getallen geplaatst voor chemische formules. Ze vertegenwoordigen het aantal moleculen of mol van elke stof die bij de reactie betrokken is. Pas deze coëfficiënten aan om het aantal atomen van elk element aan beide zijden gelijk te maken.
* Begin met het meest complexe molecuul: Vaak is het gemakkelijker om eerst het meer complexe molecuul in evenwicht te brengen.
* Breng één element tegelijk in evenwicht: Vermijd het veranderen van coëfficiënten die u al hebt aangepast.
* Verander nooit subscripts: Subscripts geven het aantal atomen in een molecuul aan. Veranderen ze verandert de chemische identiteit van de verbinding.
Voorbeeld:
* We moeten een coëfficiënt van 2 toevoegen voor H₂o:
H₂ + o₂ → 2h₂o
* Nu zijn er 4 waterstofatomen aan de productzijde, dus we moeten de coëfficiënt voor H₂ in H₂ in 2 veranderen:
2h₂ + o₂ → 2h₂o
4. Controleer de balans
* Eindverificatie: Zorg ervoor dat het aantal atomen van elk element hetzelfde is aan zowel de reactant- als de productzijde.
Voorbeeld:
* Reactantzijde:4 waterstofatomen, 2 zuurstofatomen
* Productzijde:4 waterstofatomen, 2 zuurstofatomen
De evenwichtige vergelijking: 2h₂ + o₂ → 2h₂o
belangrijke opmerkingen:
* Balancing chemische vergelijkingen is een proces van vallen en opstaan, maar met de praktijk wordt het gemakkelijker.
* Balancerende vergelijkingen zorgt ervoor dat de wet van behoud van massa wordt bevestigd:materie wordt niet gecreëerd of vernietigd in een chemische reactie.
* Sommige reacties kunnen lastig zijn om in evenwicht te zijn, waardoor zorgvuldige aandacht nodig is voor polyatomische ionen of complexe moleculen.
 Leg uit waarom kristallisatie niet geschikt zou zijn voor het zuiveren van water?
Leg uit waarom kristallisatie niet geschikt zou zijn voor het zuiveren van water?  Wat verwijst naar de kleur van poeder geschraapt van een mineraal wanneer het tegen een hard ruw oppervlak wordt gewreven?
Wat verwijst naar de kleur van poeder geschraapt van een mineraal wanneer het tegen een hard ruw oppervlak wordt gewreven?  Wat is de definitieve temperatuur?
Wat is de definitieve temperatuur?  Waarom breiden en samentrekken materialen uit wanneer de temperatuur verandert?
Waarom breiden en samentrekken materialen uit wanneer de temperatuur verandert?  In elkaar grijpende ringen ontgrendelen nieuwe materiaaleigenschappen
In elkaar grijpende ringen ontgrendelen nieuwe materiaaleigenschappen
 Wetenschapsprojecten op het ademhalingsstelsel
Wetenschapsprojecten op het ademhalingsstelsel  Op welke 2 manieren kunnen er elementen in de natuur plaatsvinden?
Op welke 2 manieren kunnen er elementen in de natuur plaatsvinden?  Zelfs voor een luchtvervuiling historicus zoals ik, de afgelopen weken waren een schok
Zelfs voor een luchtvervuiling historicus zoals ik, de afgelopen weken waren een schok Hong Kong ruimt vettige stranden op na olieramp
Hong Kong ruimt vettige stranden op na olieramp NASA ziet tropische cycloon Debbie vormen en versterken
NASA ziet tropische cycloon Debbie vormen en versterken
Hoofdlijnen
- Hoe ontgift een enzym de cellen van levende wezens?
- Wie waren de mannen die betrokken waren bij de celtheorie?
- Hoe verschillen obligate aeroben en anaëroben?
- Suiker verstoort het microbioom, elimineert bescherming tegen obesitas en diabetes
- Waarom maken ananas-enzymen de biefstuk mals – en je tong?
- Roofzuchtige bacteriën gevonden in studie van longmicrobioom van patiënten met cystische fibrose
- Waar ontwikkelt een Zygote in planten zich in?
- Als een bacterie geen glucose kan fermenteren, waarom dan zijn vermogen niet testen op andere koolhydraten?
- Genontdekking kan wereldwijde tarwe-epidemie stoppen
- Onderzoekers bestuderen aanwezigheid van gefluoreerde chemicaliën in brandweerkleding

- Het onthullen van de nanostructuur van hout zou kunnen helpen de hoogtelimieten voor houten wolkenkrabbers te verhogen

- Ingenieurs hergebruiken 19e-eeuwse fotografietechniek om rekbare, van kleur veranderende films te maken

- Machine learning framework ID's doelen voor het verbeteren van katalysatoren
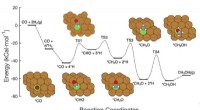
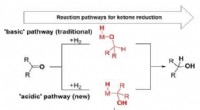
- Metaalhydriden met verbeterde stabiliteit in water
 Asteroïde Ryugu geschud door Hayabusa2s impactor
Asteroïde Ryugu geschud door Hayabusa2s impactor Hoe CFM naar MPH berekenen
Hoe CFM naar MPH berekenen  Hoe verschilt fysiek model van het wiskundige model?
Hoe verschilt fysiek model van het wiskundige model?  Waar wordt wetenschappelijk onderzoek voor gebruikt?
Waar wordt wetenschappelijk onderzoek voor gebruikt?  Wat is het verschil tussen snelheid en versnelling in phisycs?
Wat is het verschil tussen snelheid en versnelling in phisycs?  Grote energiebesparing:onderzoekers bouwen 's werelds kleinste elektro-optische modulator
Grote energiebesparing:onderzoekers bouwen 's werelds kleinste elektro-optische modulator Fossielen van gigantische zeehagedis met dolkachtige tanden laten zien hoe onze oceanen fundamenteel zijn veranderd sinds het dinosaurustijdperk
Fossielen van gigantische zeehagedis met dolkachtige tanden laten zien hoe onze oceanen fundamenteel zijn veranderd sinds het dinosaurustijdperk  Diepgaande leertechnieken leren het neurale model retrosynthese te spelen
Diepgaande leertechnieken leren het neurale model retrosynthese te spelen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

