
Wetenschap
Wat is de formele lading van nitriet?
1. Teken de Lewis -structuur
* stikstof (n): 5 valentie -elektronen
* zuurstof (O): 6 valentie -elektronen elk
* Totale valentie -elektronen: 5 + (2 x 6) + 1 (van de negatieve lading) =18
De Lewis -structuur voor nitriet heeft een dubbele binding tussen één stikstof en één zuurstof, en een enkele binding tussen stikstof en de andere zuurstof. De zuurstof met de enkele binding heeft een negatieve lading.
2. Wijs formele ladingen toe
* Formele lading =(valentie -elektronen) - (niet -bindende elektronen) - (1/2 bindingselektronen)
* stikstof:
* Valentie -elektronen:5
* Niet-bindende elektronen:0
* Bindingselektronen:8 (4 obligaties)
* Formeel lading =5 - 0 - (1/2 * 8) =+1
* zuurstof (dubbel gebonden):
* Valentie -elektronen:6
* Niet-bindende elektronen:4
* Bindingselektronen:4
* Formeel lading =6 - 4 - (1/2 * 4) =0
* zuurstof (enkel gebonden):
* Valentie -elektronen:6
* Niet-bindende elektronen:6
* Bindingselektronen:2
* Formele lading =6 - 6 - (1/2 * 2) =-1
Conclusie
De formele ladingen van nitriet zijn:
* stikstof:+1
* Dubbelgebonden zuurstof:0
* Single -bonded zuurstof:-1
 Doe gasmoleculen in lucht druk uit op de objecten die ze omringen?
Doe gasmoleculen in lucht druk uit op de objecten die ze omringen?  Welk instrument dat nauwkeuriger zou zijn voor het meten van het volume van een vloeistof?
Welk instrument dat nauwkeuriger zou zijn voor het meten van het volume van een vloeistof?  Schrijf een korte opmerkingen over SPECTRO -chemische serie?
Schrijf een korte opmerkingen over SPECTRO -chemische serie?  Cu-Fe-katalysator vergemakkelijkt de omzetting van CO2 bij omgevingsdruk in alkenen met lange keten
Cu-Fe-katalysator vergemakkelijkt de omzetting van CO2 bij omgevingsdruk in alkenen met lange keten Hoe beïnvloedt verwarming de oplosbaarheid van een opgeloste gas in vloeistof?
Hoe beïnvloedt verwarming de oplosbaarheid van een opgeloste gas in vloeistof?
 Waarom worden graslanden gevonden in de gematigde zone?
Waarom worden graslanden gevonden in de gematigde zone?  Wereld slaagt er niet in om groen Covid-herstelpad te nemen:UN
Wereld slaagt er niet in om groen Covid-herstelpad te nemen:UN Groeiende vraag naar diepere putten maakt gebruik van oude waterreserves
Groeiende vraag naar diepere putten maakt gebruik van oude waterreserves Overstromingsdetectie een verrassend vermogen van de missie van microsatellieten
Overstromingsdetectie een verrassend vermogen van de missie van microsatellieten Waarom zijn er carnivoren en herbivoor?
Waarom zijn er carnivoren en herbivoor?
Hoofdlijnen
- Wat als een hond kippenbot eet?
- Wat doet het cellulaire membraan?
- Grazende paarden op betere weiden
- Wat voor soort organisme is een plant?
- Waar paren homologe chromosomen en vormen ze synapsen?
- Wat is de specifieke celontvanger bekend?
- Waar codeert DNA voor?
- Hoe planten vrienden worden met schimmels
- De mitochondria is de site van?
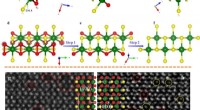
- Beheersbare oppervlaktedefect engineering op overgangsmetaal trichalcogenide
- Engineering van een polymeernetwerk om op verzoek als actieve camouflage te fungeren

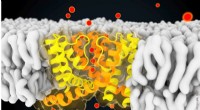
- Structurele en dynamische verschillen tussen selectieve en niet-selectieve ionkanalen
- Nieuw onderzoek optimaliseert zowel elasticiteit als stijfheid in hetzelfde materiaal zonder de gebruikelijke compromissen

- Verrassende ontdekking van celdood biedt aanwijzingen voor geboorteafwijkingen

 Hoe schrijf je .0009234 in wetenschappelijke notatie?
Hoe schrijf je .0009234 in wetenschappelijke notatie?  Nanoplastics detecteren in fracties van een seconde met behulp van gemodificeerde Raman-spectroscopie
Nanoplastics detecteren in fracties van een seconde met behulp van gemodificeerde Raman-spectroscopie  Welk type warmteoverdracht vindt plaats in alleen vloeistof en gassen?
Welk type warmteoverdracht vindt plaats in alleen vloeistof en gassen?  Hoe kan ik Comet 46p zien en wat is de beste manier om het in de nachtelijke hemel te observeren?
Hoe kan ik Comet 46p zien en wat is de beste manier om het in de nachtelijke hemel te observeren?  Wat is een manier om energietransfers in en uit het aardsysteem bij te houden?
Wat is een manier om energietransfers in en uit het aardsysteem bij te houden?  Wat maakt een goede boom? We gebruikten AI om vogels te vragen
Wat maakt een goede boom? We gebruikten AI om vogels te vragen  Grote klimaatonzekerheid, zelfs bij een temperatuurstijging van 1,5 graad
Grote klimaatonzekerheid, zelfs bij een temperatuurstijging van 1,5 graad Wat wordt pH beïnvloed?
Wat wordt pH beïnvloed?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

