
Wetenschap
Natrium en kalium vertonen een vergelijkbare reactiviteit ten opzichte van water Welke woning hebben deze elementen gemeen?
Dit is waarom:
* Elektronenconfiguratie: Alkali -metalen hebben slechts één elektron in hun buitenste schaal. Dit enkele elektron wordt relatief losjes vastgehouden en gemakkelijk verloren, waardoor ze zeer reactief zijn.
* elektropositiviteit: Ze zijn zeer elektropositief, wat betekent dat ze gemakkelijk hun buitenste elektron verliezen om een positief ion (kation) te vormen.
* Lage ionisatie -energie: Vanwege de zwakke greep op het buitenste elektron hebben alkali -metalen lage ionisatie -energieën, wat betekent dat er weinig energie voor nodig is om dit elektron te verwijderen.
Wanneer deze elementen reageren met water:
1. Ze verliezen gemakkelijk hun valentie -elektron aan een waterstofatoom in water.
2. Dit vormt waterstofgas (H2) en een metaalhydroxide.
3. De reactie geeft een significante hoeveelheid warmte vrij, waardoor het waterstofgas vaak ontstoken.
Samenvattend is de vergelijkbare reactiviteit van natrium en kalium naar water direct gekoppeld aan hun gedeelde positie in groep 1 van het periodiek systeem, wat leidt tot een gemeenschappelijke neiging om hun enkele valentie -elektron gemakkelijk te verliezen.
 Emissiedoelstellingen voor de transportsector kunnen niet worden gehaald met alleen aardgas
Emissiedoelstellingen voor de transportsector kunnen niet worden gehaald met alleen aardgas Ontmoeting met biodiversiteit, klimaat, en waterdoelstellingen via geïntegreerde strategieën
Ontmoeting met biodiversiteit, klimaat, en waterdoelstellingen via geïntegreerde strategieën Leren hoe kwelderplanten de capaciteit voor het opvangen van koolstof kunnen signaleren
Leren hoe kwelderplanten de capaciteit voor het opvangen van koolstof kunnen signaleren Waarom is objectiviteit belangrijk in forensische wetenschap?
Waarom is objectiviteit belangrijk in forensische wetenschap?  Oude bergen vastgelegd in Antarctische zandsteen onthullen mogelijke verbanden met wereldwijde gebeurtenissen
Oude bergen vastgelegd in Antarctische zandsteen onthullen mogelijke verbanden met wereldwijde gebeurtenissen
Hoofdlijnen
- Hoe wordt osmose gebruikt in het spijsverteringssysteem?
- Draagt transfer-RNA gecodeerde berichten over van de kern naar het cytoplasma?
- Een fosfolipideroute van planten naar parasieten
- Wat is een gedrag dat genetisch bepaald en niet kan worden gewijzigd?
- Is uw hond agressief? Een dierenarts legt 'woedesyndroom' uit
- Wat gebeurt er met de structuren in kern elke fase profase plus?
- Hoe je hersenen werken
- Beschrijf hoe de inhoud van een cel wordt beschermd tegen de omgeving?
- Hoe oud is jouw hond in mensenjaren? Wetenschappers ontwikkelen betere methode dan ‘vermenigvuldigen met 7’
- Ontdekking kan leiden tot krachtiger knoflook, het stimuleren van smaak en slechte adem

- De hoogste hittebestendige kunststof ooit is ontwikkeld uit biomassa
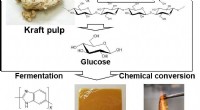
- Vastleggen van het gedrag van katalysatoren met één atoom onderweg

- Nieuwe reactie maakt indoline-steigers beschikbaar voor farmaceutische ontwikkeling

- Onderzoek identificeert essentiële olieverbindingen die het meest giftig zijn voor bedwantsen

 Wat was de ruimtesnelheid tijdens terugkeer?
Wat was de ruimtesnelheid tijdens terugkeer?  Welke van de volgende is een polair molecuul F2 CO2 PF3 CF4 of BF3?
Welke van de volgende is een polair molecuul F2 CO2 PF3 CF4 of BF3?  Wordt genoemd als de temperatuur de mogelijke totale vochtigheid verhoogt?
Wordt genoemd als de temperatuur de mogelijke totale vochtigheid verhoogt?  Rapport:Strategiewijzigingen bij Microsoft?
Rapport:Strategiewijzigingen bij Microsoft?  Wat is de lengte van een 60 Hertz -sinusgolf?
Wat is de lengte van een 60 Hertz -sinusgolf?  Hoe hangt beweging af van het referentiekader?
Hoe hangt beweging af van het referentiekader?  Oplossen voor specifieke zwaartekracht
Oplossen voor specifieke zwaartekracht  Wat zijn 3 problemen met de nevelstheorie?
Wat zijn 3 problemen met de nevelstheorie?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

