
Wetenschap
Wat is er nodig om de reactie CL2 KL KCL L2 in evenwicht te brengen?
1. Identificeer de reactanten en producten
* reactanten: CL₂ (chloorgas), ki (kaliumjodide)
* Producten: KCL (kaliumchloride), i₂ (jodium)
2. Schrijf de ongebalanceerde vergelijking
Cl₂ + Ki → KCl + I₂
3. Breng de atomen in evenwicht
* chloor (CL): Er zijn 2 chlooratomen links (CL₂) en 1 rechts (KCL). Om in evenwicht te zijn, zet je een coëfficiënt van 2 voor KCL.
* kalium (k): Er is 1 kaliumatoom aan de linkerkant (ki) en 2 rechts (2kcl). Om in evenwicht te zijn, zet je een coëfficiënt van 2 voor ki.
* jodium (i): Er is 1 jodiumatoom aan de linkerkant (ki) en 2 rechts (i₂). De vergelijking is al in balans voor jodium.
4. De evenwichtige vergelijking
De evenwichtige chemische vergelijking is:
CL₂ + 2KI → 2KCL + I₂
Verklaring:
* coëfficiënten: De getallen voor elk molecuul vertegenwoordigen het aantal moleculen dat bij de reactie betrokken is.
* Behoud van massa: De uitgebalanceerde vergelijking zorgt ervoor dat hetzelfde aantal van elk type atoom aan beide zijden van de vergelijking verschijnt, waardoor de wet van het behoud van massa wordt vervuld.
 Hoeveel atomen en elementen zijn er in waterstofperoxide?
Hoeveel atomen en elementen zijn er in waterstofperoxide?  Hoe verschilt broom van de andere niet -metalen?
Hoe verschilt broom van de andere niet -metalen?  Beschrijf de atomen die betrokken zijn bij een niet-polaire binding?
Beschrijf de atomen die betrokken zijn bij een niet-polaire binding?  Wetenschappers stellen nieuw materiaal voor om oppervlakte-eigenschappen te wijzigen
Wetenschappers stellen nieuw materiaal voor om oppervlakte-eigenschappen te wijzigen Wat is de formule voor gehydrateerd Copper II -sulfaat?
Wat is de formule voor gehydrateerd Copper II -sulfaat?
 Wat betekent opkomst in termen van de aardwetenschappen?
Wat betekent opkomst in termen van de aardwetenschappen?  Krachtige aardbeving schokt steden in Alaska, produceert kleine tsunami
Krachtige aardbeving schokt steden in Alaska, produceert kleine tsunami Chlorose is het fenomeen waar bladeren hebben?
Chlorose is het fenomeen waar bladeren hebben?  Zwarte koolstof van het zuidelijk halfrond volgen naar Antarctische sneeuw
Zwarte koolstof van het zuidelijk halfrond volgen naar Antarctische sneeuw Het achteraf aanpassen van ongebruikte ruimtes kan Zuid-Afrikaanse steden helpen zich aan te passen aan klimaatverandering
Het achteraf aanpassen van ongebruikte ruimtes kan Zuid-Afrikaanse steden helpen zich aan te passen aan klimaatverandering
Hoofdlijnen
- Hoe lijken mitochondriën en chloroplasten op bacteriën?
- Welke organel zou rijk zijn aan RNA?
- Waarom vermijden de meeste wetenschappers wetenschappelijke theorieën wetten te noemen?
- Namen van DNA-strengen
- Bijenvival:herstelt de bijenpopulatie in Texas zich?
- Het weer in november is een lastige tijd voor schildpadden
- Nestgebieden van schildpadden volgen
- Leg uit hoe DNA in de kern kan worden gerelateerd aan eiwitten en worden gemaakt ribosoom omvat hoe mutaties van invloed kunnen zijn op eiwitten?
- Wat is de stikstofgroep?
- Nieuwe technieken onderzoeken vitale en ongrijpbare eiwitten

- Wetenschappers maken kunstmatige katalysatoren geïnspireerd door levende enzymen

- LED-ing the way:een schone en handige methode om kunststof oppervlakken voor de industrie te oxideren

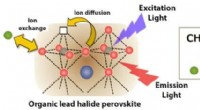
- Succes bij het beheersen van de samenstelling van perovskitionen maakt de weg vrij voor apparaattoepassingen
- Foto-responsieve eiwithydrogels als middel voor gecontroleerde afgifte van stamcellen/eiwitten
 Californië meet snowpack te midden van droge winter
Californië meet snowpack te midden van droge winter Hoeveel graden naar het zuiden is de evenaar in de breedtegraad?
Hoeveel graden naar het zuiden is de evenaar in de breedtegraad?  Hoe gaat water in en uit een cel?
Hoe gaat water in en uit een cel?  Bewijs toont aan dat algoritmen voor risicobeoordeling vooringenomenheid vertonen ten opzichte van de Spaanse bevolking
Bewijs toont aan dat algoritmen voor risicobeoordeling vooringenomenheid vertonen ten opzichte van de Spaanse bevolking Wetenschappers maken zonnepaneel door eiwit- en kwantumstippen te combineren
Wetenschappers maken zonnepaneel door eiwit- en kwantumstippen te combineren Niet-blanke wetenschappers zijn ondervertegenwoordigd in wetenschappelijke artikelen in communicatie
Niet-blanke wetenschappers zijn ondervertegenwoordigd in wetenschappelijke artikelen in communicatie Hoe zoologie is gerelateerd aan de biologie?
Hoe zoologie is gerelateerd aan de biologie?  Röntgenstralen onthullen een verborgen eigenschap die leidt tot defecten in een lithium-ionbatterijmateriaal
Röntgenstralen onthullen een verborgen eigenschap die leidt tot defecten in een lithium-ionbatterijmateriaal
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

