
Wetenschap
Waarom is vast natrium een uitstekende geleider van elektriciteit maar chloride -isolator?
Natrium (NA) - Een goede geleider
* Metallic binding: Natrium is een metaal en metalen worden gekenmerkt door metalen binding. Bij dit type binding worden de buitenste elektronen van de atomen losjes vastgehouden en kunnen vrij door het metalen rooster bewegen. Deze "vrije elektronen" zijn de sleutel tot geleidbaarheid.
* Elektronenmobiliteit: Wanneer een elektrisch veld op natrium wordt aangebracht, kunnen deze vrije elektronen gemakkelijk migreren in reactie op het veld. Deze ladingsbeweging vormt een elektrische stroom, waardoor natrium een uitstekende geleider is.
chloride (CL) - Een isolator
* ionische binding: Chloride bestaat als een ion (Cl-), meestal in ionische verbindingen zoals natriumchloride (NaCl). Bij ionische binding worden elektronen overgebracht van het ene atoom naar het andere en vormen ionen met tegengestelde ladingen die sterk tot elkaar worden aangetrokken.
* Vaste elektronen: De elektronen in chloride -ionen zijn strak gebonden binnen de ionische structuur. Ze zijn niet vrij om gemakkelijk te bewegen, in tegenstelling tot de gratis elektronen in metalen.
* Geen gratis dragers: Zonder vrije elektronen om lading te dragen, kan chloride niet effectief elektriciteit leiden, waardoor het een isolator is.
Samenvattend
Het fundamentele verschil in geleidbaarheid tussen natrium en chloride ligt in hun bindingstructuren en het gedrag van hun elektronen:
* natrium: Metallische binding met vrije elektronen zorgt voor een hoge geleidbaarheid.
* chloride: Ionische binding met strak gebonden elektronen voorkomt aanzienlijke ladingsbeweging, wat resulteert in isolatiegedrag.
 Vormveranderend element vormt de sleutel tot antibacteriële coating
Vormveranderend element vormt de sleutel tot antibacteriële coating Welk mineraal kristalliseert als laatste en is het meest resistent tegen verwering?
Welk mineraal kristalliseert als laatste en is het meest resistent tegen verwering?  Verschillende soorten gassen en hun gebruik?
Verschillende soorten gassen en hun gebruik?  De frontlinieverdediging van het immuunsysteem bevriest bacteriën in hun sporen
De frontlinieverdediging van het immuunsysteem bevriest bacteriën in hun sporen Gebruik de kinetische theorie om condensatie uit te leggen?
Gebruik de kinetische theorie om condensatie uit te leggen?
Hoofdlijnen
- De nacht zit vol met dieren, maar wetenschappers weten er heel weinig van
- Wat houdt ons tegen om algen en anaërobe bacteriën naar Mars te lanceren om te beginnen met terravorming voor mogelijke toekomstige bewoning?
- Wanneer een organisme het gevestigde ecosysteem binnengaat, concurreert het met enkele van de inheemse organismen voor voedsel als gevolg hiervan kan geheel in evenwicht worden gegooid?
- Wat veroorzaakt virussen bij mensen?
- Wat is een resultaat van een organisme dat meristem heeft?
- Uit onderzoek blijkt hoe de adelborstvis zijn urenlange paringsroep volhoudt
- Welk onderzoek omvat nooit een hypothese?
- Wat is een voorbeeld van een virus dat bolvormig is?
- Hoe pest werkt
- Enzymconformatie beïnvloedt de prestaties van lipase-aangedreven nanomotoren
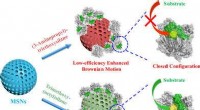
- Rekbaar, zelfherstellende en halfgeleidende polymeerfilms voor elektronische huid (e-skin)
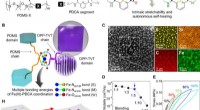
- Duurzaam transport:de lucht zuiveren met stikstofdoping

- Nieuwe methode meet 3D-polymeerverwerking nauwkeurig
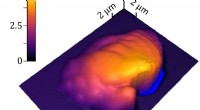
- Ingenieurs maken veelbelovend materiaal stabiel genoeg voor gebruik in zonnecellen

 Geavanceerde imager klaar voor installatie op IMAP-ruimtevaartuig
Geavanceerde imager klaar voor installatie op IMAP-ruimtevaartuig  Wat zijn de soorten eenvoudige koolhydraten?
Wat zijn de soorten eenvoudige koolhydraten?  Een recept vraagt om 4 theelepel bakpoeder en 1 fl oz vanille. Welke maatregel is groter.?
Een recept vraagt om 4 theelepel bakpoeder en 1 fl oz vanille. Welke maatregel is groter.?  Hoe Giraffes Mate?
Hoe Giraffes Mate?  Meter Stick Vs. Yard Stick
Meter Stick Vs. Yard Stick  Waarom wordt kalksteen in papier gebruikt?
Waarom wordt kalksteen in papier gebruikt?  Auto onderdelen, skischoenen en dozen:hoe kapot of gebruikt plastic een nieuw leven krijgt
Auto onderdelen, skischoenen en dozen:hoe kapot of gebruikt plastic een nieuw leven krijgt Welke van de volgende verwijdert koolstof uit de atmosfeer?
Welke van de volgende verwijdert koolstof uit de atmosfeer?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

