
Wetenschap
Schrijf de elektronenconfiguratie voor Al?
1S² 2S² 2P⁶ 3S² 3P¹
Hier is hoe je het kunt begrijpen:
* 1S²: Het eerste energieniveau (n =1) heeft één subshell (s) met 2 elektronen.
* 2S²: Het tweede energieniveau (n =2) heeft een 's' subshell met 2 elektronen.
* 2p⁶: Het tweede energieniveau heeft ook een 'P' subshell, die maximaal 6 elektronen kan bevatten.
* 3S²: Het derde energieniveau (n =3) heeft een 's' subshell met 2 elektronen.
* 3P¹: Het derde energieniveau heeft ook een 'P' subshell, die 1 elektron in aluminium heeft.
Belangrijke opmerking: Aluminium heeft 13 elektronen. De elektronenconfiguratie volgt het AUFBAU -principe, dat vullende orbitalen dicteert in volgorde van toenemende energie.
 Wat gebeurt er met vloeibare zuurstof bij verhitting?
Wat gebeurt er met vloeibare zuurstof bij verhitting?  Wat is de empirische formule voor verbinding waarvan de moleculaire C2N2?
Wat is de empirische formule voor verbinding waarvan de moleculaire C2N2?  Bereken de molariteit van een zoutzuuroplossing die 18,25 procent HCl is door massa en heeft een dichtheid 1,2 gl?
Bereken de molariteit van een zoutzuuroplossing die 18,25 procent HCl is door massa en heeft een dichtheid 1,2 gl?  Wat is het product gevormd na het verbranden van zwavel in lucht?
Wat is het product gevormd na het verbranden van zwavel in lucht?  Kunnen er meer zijn dan de 3 hoofdatomen in water?
Kunnen er meer zijn dan de 3 hoofdatomen in water?
 Verlies van Arctisch zee-ijs wakkert zomerhittegolven aan in het zuiden van de VS
Verlies van Arctisch zee-ijs wakkert zomerhittegolven aan in het zuiden van de VS Wat verwijst naar de totale fysieke omgeving van een bepaalde plaats, waaronder klimaatwaterbodems vegetatie en landvormen?
Wat verwijst naar de totale fysieke omgeving van een bepaalde plaats, waaronder klimaatwaterbodems vegetatie en landvormen?  Hoe worden planten beïnvloed in het Noordpoolgebied?
Hoe worden planten beïnvloed in het Noordpoolgebied?  Schud het op:door mensen veroorzaakte en natuurlijke aardbevingen in het centrum van de VS zijn inherent vergelijkbaar
Schud het op:door mensen veroorzaakte en natuurlijke aardbevingen in het centrum van de VS zijn inherent vergelijkbaar Wat is de rol van de zon in fotosynthese?
Wat is de rol van de zon in fotosynthese?
Hoofdlijnen
- Wat zijn de zintuigen van amfibieën?
- Welke waterbiomen is een van de meest productieve alle biomen?
- Wat zijn koolhydraten en hun functie?
- Wat is de tRNA -sequentie die past bij dit mRNA AUG ACU AGC?
- Drie artikelen helpen de code van co-enzym Q-biosynthese te kraken
- Wat veroorzaakt de beweging van voedsel door dikke darm?
- Kwallen hebben superkrachten - en andere redenen waarom ze hun slechte reputatie niet verdienen
- Nieuw onderzoek laat zien wat vissen onder het ijs van plan zijn
- Welke gepaarde organel die betrokken is bij celdeling wordt gevonden in dier maar geen plantencellen?
- Synthese van opiumalkaloïden met behulp van elektrische stroom

- Een efficiëntere op membraan gebaseerde generator voor het oogsten van osmotisch vermogen (update)
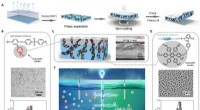
- Onderzoekers karakteriseren moleculaire scharen voor plastic afval
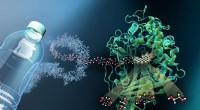
- Nieuwe polymeer mesofasestructuur ontdekt
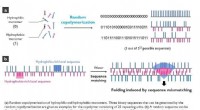
- Nieuwe strategie zet evolutie van microscopische structuren in een stroomversnelling
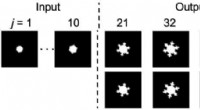
 Onderzoekers ontwikkelen een raamwerk voor het modelleren van de veerkracht van infrastructuur na aardbevingen
Onderzoekers ontwikkelen een raamwerk voor het modelleren van de veerkracht van infrastructuur na aardbevingen Waarom groeien stroperij objecten in het donker?
Waarom groeien stroperij objecten in het donker?  Volgens de wet van Coulombs, hoe beïnvloedt afstand de elektrische kracht?
Volgens de wet van Coulombs, hoe beïnvloedt afstand de elektrische kracht?  Voordelen van het gebruik van een pH-meter
Voordelen van het gebruik van een pH-meter  Wat houdt de planeten in het zonnestelsel los van elkaar?
Wat houdt de planeten in het zonnestelsel los van elkaar?  Supersterke permanente magneten maken
Supersterke permanente magneten maken  Mooie zeer grote nep sinaasappelboom waarvan u denkt dat het meer dan 30 jaar een paar takken is die de bladeren volledig zijn gestorven op sommige zijn stervende ledematen Wat gebeurt er?
Mooie zeer grote nep sinaasappelboom waarvan u denkt dat het meer dan 30 jaar een paar takken is die de bladeren volledig zijn gestorven op sommige zijn stervende ledematen Wat gebeurt er?  Wat voor soort cellen omringen ziektekiemen en slikken ze in?
Wat voor soort cellen omringen ziektekiemen en slikken ze in?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

