
Wetenschap
Waarom kunnen chloormoleculen drie verschillende waarden van massagummer hebben?
Hier is een uitsplitsing:
* isotopen: Atomen van hetzelfde element (zoals chloor) met hetzelfde aantal protonen maar verschillende aantallen neutronen. Dit verschil in neutronen leidt tot verschillende atoommassa's.
* chloorisotopen: Er zijn twee hoofdisotopen van chloor:
* chloor-35 (³⁵cl): Deze isotoop heeft 17 protonen en 18 neutronen.
* chloor-37 (³⁷cl): Deze isotoop heeft 17 protonen en 20 neutronen.
* Moleculaire massa: Een chloormolecuul (CL₂) wordt gevormd door twee chlooratomen die aan elkaar binden. Het massa -nummer van het molecuul hangt af van de combinatie van aanwezige isotopen.
Hier zijn de mogelijke combinaties en hun massagummers:
1. ³⁵cl - ³⁵cl: Het massanummer is 35 + 35 = 70
2. ³⁵cl - ³⁷cl: Het massanummer is 35 + 37 = 72
3. ³⁷cl - ³⁷cl: Het massanummer is 37 + 37 = 74
Daarom kunnen chloormoleculen drie verschillende waarden van massaummer hebben (70, 72 en 74) vanwege de aanwezigheid van twee chloorisotopen en hun verschillende combinaties in het molecuul.
 Wat wordt weergegeven door H2O H plus OH?
Wat wordt weergegeven door H2O H plus OH?  scheikunde en natuurkunde zijn zo nauw met elkaar verbonden dat de vakgebieden elkaar soms overlappen. Welke van de volgende experimenten zouden zowel scheikundigen als natuurkundigen kunnen uitvoeren?
scheikunde en natuurkunde zijn zo nauw met elkaar verbonden dat de vakgebieden elkaar soms overlappen. Welke van de volgende experimenten zouden zowel scheikundigen als natuurkundigen kunnen uitvoeren?  Waarom stroomt het gas uit als je je sneeuwblazer prime?
Waarom stroomt het gas uit als je je sneeuwblazer prime?  De formule CACL2 vertegenwoordigt de verbinding?
De formule CACL2 vertegenwoordigt de verbinding?  Helium reageert niet met een andere stof, is het nauwkeurig om te zeggen dat helium geen chemische eigenschappen heeft?
Helium reageert niet met een andere stof, is het nauwkeurig om te zeggen dat helium geen chemische eigenschappen heeft?
 Wetenschappers vragen om meer ogen in de lucht te midden van alarmerende klimaatverandering
Wetenschappers vragen om meer ogen in de lucht te midden van alarmerende klimaatverandering Permafrost-koolstofverlies vermindert de microbiële stabiliteit
Permafrost-koolstofverlies vermindert de microbiële stabiliteit Ontwikkelingslanden worden geconfronteerd met stijgende betalingen als gevolg van klimaatverandering, zegt verslag
Ontwikkelingslanden worden geconfronteerd met stijgende betalingen als gevolg van klimaatverandering, zegt verslag Wat hebben de zeebries en het land gemeen?
Wat hebben de zeebries en het land gemeen?  Waarom zijn ondiepe meren gevoelig voor eutrofiëring?
Waarom zijn ondiepe meren gevoelig voor eutrofiëring?
Hoofdlijnen
- De wetenschap van hoe planten trauma registreren omvat een voorloper van de calciumgolf
- Stijgende zeetemperaturen bedreigen Atlantische populaties van Bulwers-stormvogels
- Is DNA een type enzym dat aminozuur samenstelt om eiwitten te maken?
- Wat zijn groepen organen die samenwerken om een bepaalde baan in het lichaam te verrichten?
- Is de overbevissing voorbij? Een Amerikaanse topwetenschapper zegt ja
- Gestandaardiseerde metadata voor biologische monsters zouden het potentieel van collecties kunnen ontsluiten
- Wat betekent protolapsis?
- Welke drie dingen helpen bloed door aderen te duwen?
- De tak van de biologie die zowel het diversiteits- als de eenheidsleven verklaart?
- Technologie voor het produceren van aluminium matrixcomposieten uit nieuwe grondstoffen

- Wetenschappers vinden groene schat - zij het roestig - in de bodem

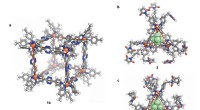
- Covalente modificatiecascade na assemblage van zelf-geassembleerde supramoleculaire structuren
- Nieuwe duurzame pulptechnologieën

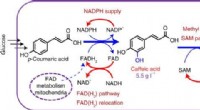
- Cofactor-engineering stimuleert de synthese van natuurlijke producten
 Schakel over naar efficiënte datacenters met fotonica
Schakel over naar efficiënte datacenters met fotonica Hoe de duisternis en de kou dinosaurussen doodden
Hoe de duisternis en de kou dinosaurussen doodden  Door werkzoekenden te vertellen hoeveel andere mensen hebben gesolliciteerd, kunnen de sollicitaties toenemen en kan de diversiteit worden vergroot
Door werkzoekenden te vertellen hoeveel andere mensen hebben gesolliciteerd, kunnen de sollicitaties toenemen en kan de diversiteit worden vergroot  Kan de vooringenomenheid in algoritmen ons helpen de onze te zien?
Kan de vooringenomenheid in algoritmen ons helpen de onze te zien?  Wat is de snelheid die een object reist en richting die het reist?
Wat is de snelheid die een object reist en richting die het reist?  De grootste mythes van de president over de bosbranden in Californië
De grootste mythes van de president over de bosbranden in Californië  Afdeling uitleggen aan een derde grader
Afdeling uitleggen aan een derde grader Nieuwe software maakt van accessoire voor mobiele telefoons een ademhalingsmonitor
Nieuwe software maakt van accessoire voor mobiele telefoons een ademhalingsmonitor
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

