
Wetenschap
Welke verbindingen vormt zuurstof?
oxiden:
* metaaloxiden: Deze worden gevormd wanneer metalen reageren met zuurstof. Voorbeelden zijn ijzeroxide (roest), aluminiumoxide en calciumoxide.
* Niet-metalen oxiden: Deze worden gevormd wanneer niet-metalen reageren met zuurstof. Voorbeelden zijn koolstofdioxide, zwaveldioxide en stikstofdioxide.
Andere verbindingen:
* water (h₂o): Een van de belangrijkste verbindingen op aarde.
* Organische verbindingen: Zuurstof is een belangrijk onderdeel van veel organische verbindingen, waaronder koolhydraten, lipiden, eiwitten en nucleïnezuren.
* peroxiden: Deze bevatten het peroxide -anion (o₂²⁻), zoals waterstofperoxide (H₂o₂).
* superoxiden: Deze bevatten het superoxide -anion (O₂⁻), zoals kalium -superoxide (KO₂).
* ozone (o₃): Een triatomisch molecuul dat een krachtig oxidatiemiddel is gevonden in de atmosfeer van de aarde.
Belangrijke opmerking: Zuurstof kan verbindingen vormen met bijna elk element, behalve enkele edelgassen zoals helium en neon.
Voorbeelden van specifieke verbindingen:
* koolmonoxide (CO): Een giftig gas.
* koolstofdioxide (co₂): Een broeikasgas die essentieel is voor fotosynthese van planten.
* Natriumchloride (NaCl): Tafelzout, gevormd door de reactie van natrium met chloor.
* zwavelzuur (H₂so₄): Een sterk zuur dat wordt gebruikt in veel industriële processen.
* salpeterzuur (hno₃): Een sterk zuur dat wordt gebruikt bij de productie van meststoffen en explosieven.
Dit is slechts een kleine steekproef van de vele verbindingen die zich zuurstof kan vormen. De diversiteit en het belang van deze verbindingen benadrukken de essentiële rol van zuurstof in chemie en biologie.
 Quick & Easy Science Fair Projects voor 8e Graders
Quick & Easy Science Fair Projects voor 8e Graders  Welke vergelijking verklaart de oplosbaarheid van p-chloorfenol in 15 procent natriumhydroxide?
Welke vergelijking verklaart de oplosbaarheid van p-chloorfenol in 15 procent natriumhydroxide?  Gebruikmaken van geometrische frustratie om batterijen af te stemmen voor meer vermogen
Gebruikmaken van geometrische frustratie om batterijen af te stemmen voor meer vermogen Stop die BPA-vrije drinkflessen in de vaatwasser voordat je ze gebruikt
Stop die BPA-vrije drinkflessen in de vaatwasser voordat je ze gebruikt Soild van algemeen beschikbare verbinding is lichter dan de vloeibare vorm?
Soild van algemeen beschikbare verbinding is lichter dan de vloeibare vorm?
 Meer bewijs dat het weer in Californië naar extremen neigt
Meer bewijs dat het weer in Californië naar extremen neigt Alsof je een vrachtwagen stationair laat draaien in je woonkamer:de giftige kosten van houtgestookte kachels
Alsof je een vrachtwagen stationair laat draaien in je woonkamer:de giftige kosten van houtgestookte kachels Dieren in het tropisch regenwoud-ecosysteem
Dieren in het tropisch regenwoud-ecosysteem  De geesteswetenschappen in Amerika – een bedreigde diersoort?
De geesteswetenschappen in Amerika – een bedreigde diersoort?  Zullen voedselketens breken naarmate de seizoenen onvoorspelbaarder worden?
Zullen voedselketens breken naarmate de seizoenen onvoorspelbaarder worden?
Hoofdlijnen
- Wat gebeurt er met cytokinese in dierlijke cellen?
- Onderzoek toont aan hoe de vogelgriep kan worden uitgeroeid door de genen van kippen te bewerken
- Wat is algemene test voor eiwitten?
- Hoe stamcellen van planten zichzelf vernieuwen:een cytokinineverhaal
- Wat is een vorm van eigenschap die een organisme weergeeft?
- Wat is er in vloeibaar plantaardig voedsel?
- Nieuw onderzoek laat zien hoe verstoring van de tarwehandel de voedselzekerheid kan beïnvloeden
- Groot met vloeistof gevuld organel in volwassen plantencellen?
- Hoe maak je een Bacterial Flowchart
- Duurzame bioplastics maken van elektriciteitsetende microben

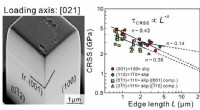
- Micropijlercompressie voor het vinden van hittebestendige legeringen
- Ingenieurs maken injecteerbare weefsels werkelijkheid

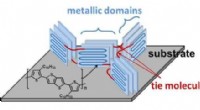
- Kunststoffen losmaken voor het opladen van Internet-of-Things-apparaten
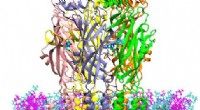
- Supersimulaties bieden nieuw inzicht in serotoninereceptoren
 Heeft het wonen in de buurt van windturbines een negatieve invloed op de menselijke gezondheid?
Heeft het wonen in de buurt van windturbines een negatieve invloed op de menselijke gezondheid?  Onverwachte periodieke uitbarstingen kunnen licht werpen op de aanwas van zwarte gaten
Onverwachte periodieke uitbarstingen kunnen licht werpen op de aanwas van zwarte gaten Is cyclohexaan een polair oplosmiddel of niet -oplosmiddel?
Is cyclohexaan een polair oplosmiddel of niet -oplosmiddel?  Uber boekt grootste kwartaalverlies ooit na uitbetaling van aandelen
Uber boekt grootste kwartaalverlies ooit na uitbetaling van aandelen Waarom zijn de chemische eigenschappen van Argon Krypton en Xenon vergelijkbaar, hoewel er 18 elementen tussen 32 Xenon zijn?
Waarom zijn de chemische eigenschappen van Argon Krypton en Xenon vergelijkbaar, hoewel er 18 elementen tussen 32 Xenon zijn?  Wat is de groottevergelijking van Saturnus en Mercurius?
Wat is de groottevergelijking van Saturnus en Mercurius?  Beter dan Star Wars:Chemie-ontdekking levert 3D-tafelobjecten op die zijn gemaakt van licht
Beter dan Star Wars:Chemie-ontdekking levert 3D-tafelobjecten op die zijn gemaakt van licht Ontdekking kan leiden tot krachtiger knoflook, het stimuleren van smaak en slechte adem
Ontdekking kan leiden tot krachtiger knoflook, het stimuleren van smaak en slechte adem
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

