
Wetenschap
Welke heeft de laagste electronegativiteit jodium of chloor?
Dit is waarom:
* elektronegativiteitstrend: Elektronegativiteit neemt toe naarmate je over een periode (van links naar rechts) beweegt en afneemt als je een groep (van boven naar beneden) in de periodiek systeem naar beneden beweegt.
* Locatie: Chloor bevindt zich boven jodium in dezelfde groep (groep 17, halogenen).
* Atomaire maat: Jodium is groter dan chloor vanwege het toegenomen aantal elektronenschalen. Het grotere formaat betekent dat de buitenste elektronen verder van de kern zijn en minder strak worden vastgehouden, wat leidt tot lagere elektronegativiteit.
Daarom heeft chloor een hogere aantrekkingskracht voor gedeelde elektronen in een binding in vergelijking met jodium.
 Massaspectrometriebeeldvorming maakt ingrediënten, additieven en contaminanten van voedsel zichtbaar
Massaspectrometriebeeldvorming maakt ingrediënten, additieven en contaminanten van voedsel zichtbaar Onderzoekers onthullen gastreactiegestuurde kooi aan Siamese tweelingkooi, mitose-achtige gastheertransformatie
Onderzoekers onthullen gastreactiegestuurde kooi aan Siamese tweelingkooi, mitose-achtige gastheertransformatie Mager elektrolytontwerp is een game-changer voor magnesiumbatterijen
Mager elektrolytontwerp is een game-changer voor magnesiumbatterijen Wat gebeurt er als u meer opgeloste stof toevoegt aan een oplosmiddel?
Wat gebeurt er als u meer opgeloste stof toevoegt aan een oplosmiddel?  Mengsels zijn altijd combinaties van dezelfde verbindingen die in verschillende staten?
Mengsels zijn altijd combinaties van dezelfde verbindingen die in verschillende staten?
Hoofdlijnen
- Wetenschappelijke methode controles en variabelen deel 1?
- Waarom is een hypothese niet alleen gok?
- Wanneer evolueerden eukaryotische cellen?
- Wat is de belangrijkste rol van eierstokken en testikels bij de mens?
- Mogelijk is er een nieuwe biologieregel aan het licht gekomen, die het inzicht in evolutie en veroudering vergroot
- Welk type dermale cel heeft meer chloroplasten dan andere cellen omdat deze grotere energiebehoeften nodig hebben?
- Hoeveel paar chromosomen zijn er in elke lichaamscel?
- Wat zijn dromen?
- Welk micoorganisme wordt verspreid door de release van sporen?
- Groene waterstof:roest als fotoanode en zijn grenzen

- Kristalstructuurvoorspelling van willekeurige legering met meerdere elementen
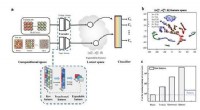
- Computers leren om miljarden mogelijke materialen intelligent te ontwerpen

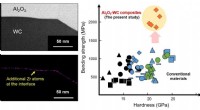
- Zirkonium gebruiken als additief in supersterke composietmaterialen
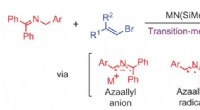
- Overgangsmetaalvrije koolstof-koolstofbindingsvormende reactie:vinylering van azaallyls
 De waarheid achter St. Patricks Day:vieringen zijn niet ontstaan in Boston
De waarheid achter St. Patricks Day:vieringen zijn niet ontstaan in Boston Waarom dipoolmoment is nul in niet -polaire moleculen moleculen?
Waarom dipoolmoment is nul in niet -polaire moleculen moleculen?  Kan een kunstmatig koraalrif de mariene biodiversiteit beschermen tegen klimaatveranderingen?
Kan een kunstmatig koraalrif de mariene biodiversiteit beschermen tegen klimaatveranderingen?  Een grafiek die de helderheid versus temperatuur van sterren beraamt?
Een grafiek die de helderheid versus temperatuur van sterren beraamt?  Waarom kunnen geologen geen aardbevingen voorspellen?
Waarom kunnen geologen geen aardbevingen voorspellen?  Welke soorten planten leven in een mistwoestijn?
Welke soorten planten leven in een mistwoestijn?  Nieuwe inzichten in een oud medicijn:wetenschappers ontdekken waarom aspirine zo goed werkt
Nieuwe inzichten in een oud medicijn:wetenschappers ontdekken waarom aspirine zo goed werkt  Steenkool en benzine zijn voorbeelden van.
Steenkool en benzine zijn voorbeelden van.
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

