
Wetenschap
In zoutzuur hcl oriënteert het waterstofatoom zichzelf zo ver weg mogelijk van elkaar omdat deze opstelling?
Dit is waarom:
* elektronenwolken: Waterstofatomen hebben, net als alle atomen, een wolk van negatief geladen elektronen rondom hun positief geladen kern.
* elektrostatische afstoting: Zoals ladingen afstoten. Wanneer twee waterstofatomen dicht bij elkaar zijn, overlappen hun elektronenwolken zich, wat resulteert in een afstotende kracht tussen de negatieve ladingen.
* Minimalisatie van afstoting: De meest stabiele opstelling is er een waarbij de waterstofatomen zo ver mogelijk uit elkaar liggen, waardoor deze elektrostatische afstoting wordt geminimaliseerd en de totale energie van het molecuul wordt verlaagd.
In het geval van HCl betekent dit dat het molecuul lineair is:
* waterstof (H) staat aan het ene uiteinde van het molecuul.
* chloor (CL) bevindt zich aan het andere uiteinde van het molecuul.
* De H-Cl-binding: De waterstof- en chlooratomen zijn verbonden door een covalente binding, waarbij ze elektronen delen.
Deze lineaire opstelling maximaliseert de afstand tussen de waterstofatomen, waardoor het molecuul stabieler wordt.
 Welk natuurlijk proces kan het oppervlak van de aarde veranderen door gletsjers wind en overstromingen?
Welk natuurlijk proces kan het oppervlak van de aarde veranderen door gletsjers wind en overstromingen?  Onderzoekers vragen Amerikanen:'Hoe ziet God eruit?'
Onderzoekers vragen Amerikanen:'Hoe ziet God eruit?'  Drie voorbeelden van omgevingsstoornissen in biomen
Drie voorbeelden van omgevingsstoornissen in biomen Bioaccumulatie van uitgefaseerde brandvertragers neemt langzaam af bij Amerikaanse zeearenden
Bioaccumulatie van uitgefaseerde brandvertragers neemt langzaam af bij Amerikaanse zeearenden Kernen van meerbodems in Alaska laten zien dat uitdijende arctische struiken de erosie kunnen vertragen
Kernen van meerbodems in Alaska laten zien dat uitdijende arctische struiken de erosie kunnen vertragen
Hoofdlijnen
- RNA-dynamiek gedeconstrueerd:Techniek biedt gedetailleerd inzicht in hoe niveaus veranderen
- Hoe noem je een wetenschapper die bestudeert voor ziekten?
- Waarom vleermuizen niet ziek worden van de dodelijke ziekten die ze met zich meedragen
- Waar zijn de cellen van de tegenstander-proces zich gevestigd?
- Het vastleggen van extracellulaire blaasjes:een nieuwe technologie voor het isoleren van ziektemarkers
- Wat reguleren het zenuwstelsel en endocriene beide het lichaam door?
- Waaruit bestaan weefsels in het lichaam?
- De AlphaFold 3-upgrade maakt de voorspelling van andere soorten biomoleculaire systemen mogelijk
- Wat is het ultieme eindresultaat van glycolyse?
- Krachten meten van levende cellen en micro-organismen

- Quantum dots en een smartphone gebruiken om dodelijke bacteriën te vinden

- Omkeerbare plakkerigheid in tandcement is iets om over te lachen
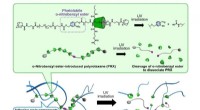
- Oprolbare tv's en buigbare smartphones:de toekomst van flexibele elektronische materialen

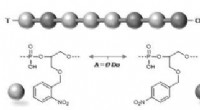
- Geheime berichten verborgen in lichtgevoelige polymeren
 Wat regelt de manier waarop een bal in de ruimte beweegt?
Wat regelt de manier waarop een bal in de ruimte beweegt?  Wat is 1 cm gelijk aan in vierkante centimeters?
Wat is 1 cm gelijk aan in vierkante centimeters?  Wat zijn kleine buitenaardse deeltjes die fel gloeien en branden terwijl ze door de atmosfeer van de aarde reizen, zijn het asteroïden of microcomets mesocoronas meteoroïden?
Wat zijn kleine buitenaardse deeltjes die fel gloeien en branden terwijl ze door de atmosfeer van de aarde reizen, zijn het asteroïden of microcomets mesocoronas meteoroïden?  Noem een grote vulkaan in de buurt van Napels, dit barstte uit de stad Pompeii in 79 na Christus?
Noem een grote vulkaan in de buurt van Napels, dit barstte uit de stad Pompeii in 79 na Christus?  Wanneer energie verloren gaat in het ecosysteem?
Wanneer energie verloren gaat in het ecosysteem?  Webbs mid-infrared spectroscopie zal moleculen, elementen onthullen
Webbs mid-infrared spectroscopie zal moleculen, elementen onthullen Bevat het supermassieve zwartgat in het midden van uw sterrenstelsel het meeste massale sterrenstelsel?
Bevat het supermassieve zwartgat in het midden van uw sterrenstelsel het meeste massale sterrenstelsel?  Het effect van temperatuur op de fotosynthesesnelheid
Het effect van temperatuur op de fotosynthesesnelheid
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

