
Wetenschap
Wat is de valentie van zwavel?
* Elektronische configuratie: Zwavel heeft 6 valentie -elektronen (elektronen in de buitenste schaal).
* octetregel: Zwavel heeft de neiging elektronen te winnen of te delen om een stabiel octet (8 elektronen) in zijn buitenste schaal te bereiken.
Gemeenschappelijke valenties van zwavel:
* +2: Zwavel kan 2 elektronen verliezen en kationen zoals S²⁺ vormen (gevonden in sommige sulfiden).
* +4: Zwavel kan 4 elektronen verliezen en kationen zoals S⁴⁺ vormen (gevonden in sommige zwaveloxiden).
* +6: Zwavel kan 6 elektronen verliezen en kationen zoals S⁶⁺ vormen (gevonden in sommige zwavelverbindingen zoals zwavelzuur).
* -2: Zwavel kan 2 elektronen krijgen en anionen als S²⁻ vormen (gevonden in sulfiden zoals natriumsulfide).
Voorbeelden:
* sulfiden: In verbindingen zoals H₂s (waterstofsulfide) heeft zwavel een valentie van -2.
* zwaveldioxide (So₂): Zwavel heeft een valentie van +4.
* zwaveltrioxide (So₃): Zwavel heeft een valentie van +6.
* zwavelzuur (H₂so₄): Zwavel heeft een valentie van +6.
Belangrijke opmerking: De valentie van zwavel wordt beïnvloed door de elektronegativiteit van de andere elementen waarmee hij zich verbindt.
 Hoe werkt een gasketel en waarvoor wordt het gebruikt?
Hoe werkt een gasketel en waarvoor wordt het gebruikt?  Wat is een mengsel van stofzuren en andere chemicaliën die gevaarlijk kunnen zijn voor de menselijke gezondheid?
Wat is een mengsel van stofzuren en andere chemicaliën die gevaarlijk kunnen zijn voor de menselijke gezondheid?  Welke twee kenmerken van de laag maken het mogelijk om zoveel waterdamp vast te houden?
Welke twee kenmerken van de laag maken het mogelijk om zoveel waterdamp vast te houden?  Een onwaarschijnlijk huwelijk tussen oxiden
Een onwaarschijnlijk huwelijk tussen oxiden Is Calciet een niet-silicaatmateriaal?
Is Calciet een niet-silicaatmateriaal?
 Wij vertrouwen op de wetenschap. Waarom laat het ons in de steek terwijl we het het meest nodig hebben?
Wij vertrouwen op de wetenschap. Waarom laat het ons in de steek terwijl we het het meest nodig hebben?  Overheden kunnen overbemesting aan banden leggen
Overheden kunnen overbemesting aan banden leggen Dodelijke winterstorm bedekt het oosten van de VS in sneeuw
Dodelijke winterstorm bedekt het oosten van de VS in sneeuw Vervuilingscontroles helpen de rode spar terug te kaatsen van zure regen
Vervuilingscontroles helpen de rode spar terug te kaatsen van zure regen Wat zijn drie voorbeelden van milieuveranderingen die betrokken zijn bij de evolutie?
Wat zijn drie voorbeelden van milieuveranderingen die betrokken zijn bij de evolutie?
Hoofdlijnen
- De grafiek hierboven toont de frequentieverdeling van een vispopulatie vóór en nadat wetenschappers gedurende vele generaties bezig waren met een kweekprogramma. uitleg beschrijft het programma het beste?
- Vertonen organismen die zijn geproduceerd als resultaat van binaire splijting een grote genetische variatie?
- Wat is gegevensorganisatie bij het oplossen van een biologisch probleem?
- Welke tak van de geneeskunde richt zich op de studietumoren en kanker?
- De Rode Zee heeft mogelijk een kraamkamer voor oceanische mantaroggen
- Golgi-apparaat: functie, structuur (met analogie en diagram)
- Bronnen van de Lactase Enzyme
- Een bericht van de genen die chromosomen worden gedragen naar ribosomen door?
- Hoe een schimmel mieren in zombies verandert
- Grote stap voorwaarts in de productie van groene waterstof

- Gebruikmaken van geometrische frustratie om batterijen af te stemmen voor meer vermogen
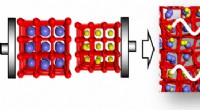
- Gereconstitueerde zijde kan meerdere keren sterker zijn dan de natuurlijke vezel en in verschillende vormen worden gemaakt

- Tumoren direct aanvallen bij identificatie

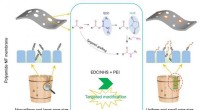
- Nieuwe gerichte modificatiestrategie verbetert de selectiviteit van polyamide nanofiltratiemembranen
 USGS vindt enorme voorraden zout water onder de grond
USGS vindt enorme voorraden zout water onder de grond Gezondheidscrisis:jaarlijks kan tot een miljard ton afval in de open lucht worden verbrand
Gezondheidscrisis:jaarlijks kan tot een miljard ton afval in de open lucht worden verbrand Welke weerswijden sneller graniet of marmer?
Welke weerswijden sneller graniet of marmer?  EU's strenge nieuwe regels voor gegevensbescherming
EU's strenge nieuwe regels voor gegevensbescherming Het vermengen van stervormende wolken verklaart waarom broers en zussen op elkaar lijken
Het vermengen van stervormende wolken verklaart waarom broers en zussen op elkaar lijken  Transparant geleidend materiaal kan leiden tot stroomopwekkende ramen
Transparant geleidend materiaal kan leiden tot stroomopwekkende ramen Wat doet een voeding in het circuit?
Wat doet een voeding in het circuit?  Wat was de meest noordelijke lijn van breedtegraad die Ponce de Leon bereikte?
Wat was de meest noordelijke lijn van breedtegraad die Ponce de Leon bereikte?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

