
Wetenschap
Waarom wordt kaliumatoom positief geladen en wordt fluor negatief geladen?
kalium (k)
* Elektronenconfiguratie: Kalium heeft 19 elektronen. De elektronenconfiguratie is [AR] 4S¹. Dit betekent dat het één elektron heeft in zijn buitenste schaal (de 4S -schaal).
* De neiging om een elektron te verliezen: Kalium heeft een lage ionisatie -energie, wat betekent dat het niet veel energie nodig heeft om het buitenste elektron te verwijderen. Door dit elektron te verliezen, bereikt kalium een stabiele elektronenconfiguratie zoals de Noble Gas Argon (AR).
* Vorming van een kation: Wanneer kalium een elektron verliest, wordt het een positief geladen ion (k⁺). De positieve lading komt van de onbalans tussen protonen (positieve lading) en elektronen (negatieve lading).
fluor (f)
* Elektronenconfiguratie: Fluor heeft 9 elektronen. De elektronenconfiguratie is [HE] 2S² 2P⁵. Het heeft 7 elektronen in zijn buitenste schaal (de 2P -schaal).
* neiging om een elektron te winnen: Fluor heeft een hoge elektronegativiteit, wat betekent dat het sterk elektronen aantrekt. Door één elektron te verkrijgen, voltooit het zijn buitenste schaal (2p) en bereikt het een stabiele elektronenconfiguratie zoals de Noble Gas Neon (NE).
* Vorming van een anion: Wanneer fluor een elektron krijgt, wordt het een negatief geladen ion (F⁻). De negatieve lading komt van de overmaat elektronen in vergelijking met protonen.
Samenvatting
Kalium verliest een elektron om een stabiele elektronenconfiguratie te bereiken en wordt een positief geladen kation (k⁺). Fluor krijgt een elektron om een stabiele elektronenconfiguratie te bereiken en wordt een negatief geladen anion (F⁻). Deze uitwisseling van elektronen is wat de vorming van ionische bindingen drijft, waarbij de tegengesteld geladen ionen elkaar aantrekken.
 Hoeveel vaten olie per inch in een tank van 436 bbl?
Hoeveel vaten olie per inch in een tank van 436 bbl?  Is aluminiumoxide -mengselelement of verbinding?
Is aluminiumoxide -mengselelement of verbinding?  Hoe zijn de donkerreacties die in planten optreden afhankelijk van lichtreacties?
Hoe zijn de donkerreacties die in planten optreden afhankelijk van lichtreacties?  Onderzoekers ontwikkelen synthetische T-cellen die de vorm nabootsen, functie van menselijke versie
Onderzoekers ontwikkelen synthetische T-cellen die de vorm nabootsen, functie van menselijke versie Onderzoekers vinden een nieuwe toepassing voor afval
Onderzoekers vinden een nieuwe toepassing voor afval
 Waarom vleermuizen tegen muren vliegen
Waarom vleermuizen tegen muren vliegen  Methaan in de atmosfeer stijgt, en dat baart wetenschappers zorgen
Methaan in de atmosfeer stijgt, en dat baart wetenschappers zorgen Waarom wordt een Firefly gezegd dat het een natuurlijke bron van licht is?
Waarom wordt een Firefly gezegd dat het een natuurlijke bron van licht is?  Naarmate meer van de Pacific Northwest brandt, ernstige branden veranderen bosecologie
Naarmate meer van de Pacific Northwest brandt, ernstige branden veranderen bosecologie NASA ziet de vorming van vroege tropische depressie in de Atlantische Oceaan
NASA ziet de vorming van vroege tropische depressie in de Atlantische Oceaan
Hoofdlijnen
- Ideeën voor Cookie Science Fair Projects
- Waarom is vrouwelijke seksualiteit flexibeler dan mannelijke seksualiteit?
- Hoe ziet de toekomst van plastic eruit?
- Wie is Master of Biology?
- Wat zou de chloroplast in een mobiele telefoon zijn?
- Wat zijn 2 soorten permanente weefsels?
- Agressiede-escalatiegen geïdentificeerd in fruitvliegjes
- Welk orgaan van het lichaam is geen permeabel membraan?
- Wat is essentieel voor het overleven van soorten en organisme niet nodig?
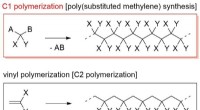
- Ontwikkeling van nieuwe slimme zachte materialen:Synthese van een pH-responsief gedendroniseerd poly(gesubstitueerd methyleen)s
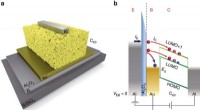
- Marcus-regime in organische apparaten - grensvlakladingsoverdrachtsmechanisme geverifieerd
- Eenvoudige test kan fluoridegerelateerde ziekte voorkomen

- Studie legt basis voor toekomstig medicijnontwerp

- Gemultiplexte biosensoren in het voordeel van de gezondheidszorg

 Lijst van Maines Natural Resources
Lijst van Maines Natural Resources Welke industrieën vaak werknemersgeologen?
Welke industrieën vaak werknemersgeologen?  Studie laat zien hoe weinig we weten over vrouwelijke terroristen
Studie laat zien hoe weinig we weten over vrouwelijke terroristen Wat is het naamgevingssysteem ontwikkeld door Carl Linnaeus dat wetenschappers gebruiken om een organisme te noemen?
Wat is het naamgevingssysteem ontwikkeld door Carl Linnaeus dat wetenschappers gebruiken om een organisme te noemen?  Probiotica beschermen tegen de maag
Probiotica beschermen tegen de maag Wat produceren zoogdieren dat planten gebruiken?
Wat produceren zoogdieren dat planten gebruiken?  Hoe planetaire nevels hun vorm krijgen
Hoe planetaire nevels hun vorm krijgen Hoe denken astronomen dat kraters op de maan en planeten zijn gemaakt?
Hoe denken astronomen dat kraters op de maan en planeten zijn gemaakt?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

