
Wetenschap
Wat is de gebalanceerde vergelijking voor een gasvormig mengsel dat 4,15 mol waterstofgas en 7,13 mol zuurstof reageert om stoom te vormen?
1. De evenwichtige chemische vergelijking:
De reactie tussen waterstofgas (H₂) en zuurstofgas (O₂) om stoom te produceren (H₂o) is:
2 H₂ (G) + O₂ (G) → 2 H₂o (G)
2. Het bepalen van de beperkende reactant:
* Bereken de mol water die uit elke reactant kan worden geproduceerd:
* waterstof: 4.15 mol H₂ * (2 mol H₂o / 2 mol H₂) =4.15 mol H₂o
* zuurstof: 7.13 mol o₂ * (2 mol H₂o / 1 mol o₂) =14.26 mol H₂o
* De beperkende reactant is degene die de minste hoeveelheid product produceert. In dit geval is waterstof de beperkende reactant.
3. De evenwichtige vergelijking met de beperkende reactant:
Omdat waterstof de beperkende reactant is, weerspiegelt de gebalanceerde vergelijking de maximale hoeveelheid water die kan worden geproduceerd uit de beschikbare waterstof:
2 H₂ (G) + O₂ (G) → 2 H₂o (G)
Belangrijke opmerking: De zuurstof is overtollig. Hoewel je begon met 7.13 mol zuurstof, zal slechts een deel ervan reageren om alle waterstof te consumeren.
 Welke van de volgende producten is smeedbaar goudaardewerk, ijs, tafelzout of glas?
Welke van de volgende producten is smeedbaar goudaardewerk, ijs, tafelzout of glas?  Wat is het verschil tussen thiamine en thiamine?
Wat is het verschil tussen thiamine en thiamine?  Wanneer zink reageert met zuren die waterstofgas produceren, is dit dan een chemische of fysieke verandering?
Wanneer zink reageert met zuren die waterstofgas produceren, is dit dan een chemische of fysieke verandering?  Wat zijn veiligheidsregels in het laboratorium?
Wat zijn veiligheidsregels in het laboratorium?  Wat is de chemische formule voor AL203?
Wat is de chemische formule voor AL203?
 De botten van een oude Maya-ambassadeur tonen een leven vol voorrechten en ontberingen
De botten van een oude Maya-ambassadeur tonen een leven vol voorrechten en ontberingen  Convectie over de hele mantel met tektonische platen behoudt wereldwijde patronen van de geochemie van de bovenste mantel op lange termijn
Convectie over de hele mantel met tektonische platen behoudt wereldwijde patronen van de geochemie van de bovenste mantel op lange termijn NASA ontdekt dat wind Tropical Storm 04W uit elkaar heeft gescheurd
NASA ontdekt dat wind Tropical Storm 04W uit elkaar heeft gescheurd Hoe beïnvloedt het weer ons?
Hoe beïnvloedt het weer ons?
Weer, bewust of onbewust, beïnvloedt de dagelijkse keuzes die u maakt. Het helpt om te bepalen of je je kleedt om warm of koel te blijven, geniet van activiteiten buiten of blijf binnen - of evacueer naar een veilige pl
 Welke term beschrijft de neiging van een object om weerstand te bieden aan een verandering in beweging?
Welke term beschrijft de neiging van een object om weerstand te bieden aan een verandering in beweging?
Hoofdlijnen
- Voerrelaties in ecosystemen worden het best vertegenwoordigd door wat?
- Wat is het verschil tussen de Charls -theorie van natuurlijke selectie en sociaal overleving fittest?
- RNA is misschien niet het eerste erfelijke systeem geweest dat zich ontwikkelt?
- Waarom zijn wetenschappers zo geïnteresseerd in extremofielen?
- Creatief beheer van begrazing door het gebruik van kleine branden
- Biologische en conventionele melk:appels met appels vergelijken?
- Hoeveel soorten weefsel maken onze hersenen?
- Klimaatverandering die de migratiepatronen van gierende kraanvogels beïnvloedt, studie vondsten
- Waarom zijn er 61 Anticodonen?
- Het bepalen van de verslanking van houtpulp
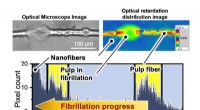
- Het aangaan van een 100 jaar oude uitdaging zou de weg kunnen banen naar digitale aroma's

- Levenscyclusanalyse lokaliseert duurzaamheidshotspots in biochemische productie

- Klaar voor de zomerzon met groene zonneschermen
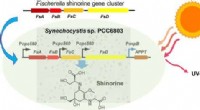
- Techniek combineert op licht gebaseerde analytische methoden met microfluïdische monsterverwerking voor de diagnose van pathogenen

 Stranden verbieden zonnebrandcrème om koraalriffen te redden
Stranden verbieden zonnebrandcrème om koraalriffen te redden Atlantisch orkaanseizoen kan extreem actief zijn:NOAA
Atlantisch orkaanseizoen kan extreem actief zijn:NOAA Hoe scheikundigen moleculaire assemblagelijnen bouwen
Hoe scheikundigen moleculaire assemblagelijnen bouwen Klimaatwetenschappers zijn geloofwaardiger als ze praktiseren wat ze prediken
Klimaatwetenschappers zijn geloofwaardiger als ze praktiseren wat ze prediken  Naar een veiligere verwijdering van printplaten
Naar een veiligere verwijdering van printplaten Hoe perfect kan grafeen zijn?
Hoe perfect kan grafeen zijn? Hoe zijn alkali -metalen tot edelgassen?
Hoe zijn alkali -metalen tot edelgassen?  Wat gebeurt er met de aantrekkingskrachten tussen deeltjes als de temperatuur verandert, en waarom?
Wat gebeurt er met de aantrekkingskrachten tussen deeltjes als de temperatuur verandert, en waarom?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

