
Wetenschap
Wat is de pH -waarde van aluminiumchloride?
Dit is waarom:
* alcl₃ is het zout van een sterk zuur (HCl) en een zwakke basis (AL (OH) ₃). Dit betekent dat wanneer Alcl₃ oplost in water, dit hydrolyse ondergaat:
* Al³⁺ (aq) + h₂o (l) ⇌ al (oh) ²⁺ (aq) + h⁺ (aq)
* Deze reactie produceert hydroniumionen (H⁺) , het maken van de oplossing zuur .
* De pH van de oplossing wordt bepaald door de concentratie van H⁺ -ionen. Een hogere concentratie van H⁺ -ionen zal resulteren in een lagere pH (meer zuur).
* In solide vorm heeft Alcl₃ geen pH -waarde. Het is alleen wanneer het oplost in water dat het zure eigenschappen vertoont.
Daarom moet u, om de pH van een aluminiumchloride -oplossing te bepalen, de concentratie ervan kennen.
Opmerking: U kunt de volgende formule gebruiken om de pH van een oplossing van alcl₃ te berekenen:
pH =-log [H⁺]
waarbij [H⁺] de concentratie van waterstofionen in de oplossing is.
Het berekenen van de exacte pH voor een bepaalde concentratie ALCL₃ kan echter complex zijn vanwege de meervoudige equilibria die betrokken zijn bij het hydrolyseproces. Het is vaak gemakkelijker om een pH -meter te raadplegen of een chemische calculator te gebruiken voor nauwkeurige metingen.
 Is het Sweetgum -blad eenvoudig of samengesteld?
Is het Sweetgum -blad eenvoudig of samengesteld?  Wat zijn de chemische formules voor marmer?
Wat zijn de chemische formules voor marmer?  170 ml van een koper II -acetaatoplossing van 0,30 m wordt gemengd met een overtollig natriumsulfide Hoeveel gram zal zich vormen?
170 ml van een koper II -acetaatoplossing van 0,30 m wordt gemengd met een overtollig natriumsulfide Hoeveel gram zal zich vormen?  Hoe de concentratie te vinden wanneer u de pH
Hoe de concentratie te vinden wanneer u de pH Wat is de juiste plaatsing van waterstof in het periodieke tabel?
Wat is de juiste plaatsing van waterstof in het periodieke tabel?
 Laserbehandelde kurk absorbeert olie voor een koolstofneutrale schoonmaak van de oceaan
Laserbehandelde kurk absorbeert olie voor een koolstofneutrale schoonmaak van de oceaan  Waarom de klimaatverandering sommigen ertoe aanzet geen kinderen te krijgen
Waarom de klimaatverandering sommigen ertoe aanzet geen kinderen te krijgen  Droomteam om ijsverlies op Groenlandse gletsjer te bestuderen om stijgende oceanen beter te voorspellen
Droomteam om ijsverlies op Groenlandse gletsjer te bestuderen om stijgende oceanen beter te voorspellen Klimaatbetrokkenheid uitlokken
Klimaatbetrokkenheid uitlokken Wat is het pad van een object terwijl het draait om een ander object?
Wat is het pad van een object terwijl het draait om een ander object?
Hoofdlijnen
- Waarom is eiwitsynthese belangrijk?
- Studie werpt licht op hoe scramblase-eiwitten celmembranen herschikken
- Wat is het dubbele membraan rond de kern?
- Uit onderzoek blijkt dat bedwantsen potentieel gevaarlijke hoeveelheden histamine produceren
- Wat is een gen,
- Onderzoekers rapporteren over mechanismen van genregulerende divergentie tussen soorten
- Somatische en genetische schade veroorzaakt door straling
- Welke wet beschrijft genen op chromosomen die scheiden?
- Hoe cheeta's elkaar vinden na hun scheiding
- Onderzoekers vinden potentieel gebruik voor gerecycled plastic in beton

- Onderzoekers boeken vooruitgang in ontziltingstechnologie

- Hoe sensoren op de huid te plakken zonder lijm?
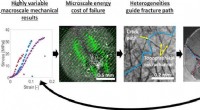
- XSEDE-supercomputertoewijzingen op Stampede1 en Comet helpen bij het vouwen van eiwitten in onderzoek naar botregeneratie
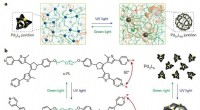
- Lichtgestuurde polymeren kunnen wisselen tussen stevig en zacht
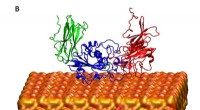
 Samen sterker:hoe eiwitfilamenten op elkaar inwerken
Samen sterker:hoe eiwitfilamenten op elkaar inwerken  Hoe worden sedimentaire metamorfe en stolling gevormd?
Hoe worden sedimentaire metamorfe en stolling gevormd?  Uit onderzoek blijkt waarom hedgefondsen een onwaarschijnlijk grote bron van systeemrisico zijn
Uit onderzoek blijkt waarom hedgefondsen een onwaarschijnlijk grote bron van systeemrisico zijn  Eendimensionale kristallen voor thermo-elektrische koeling bij lage temperatuur
Eendimensionale kristallen voor thermo-elektrische koeling bij lage temperatuur 2019 op één na warmste jaar ooit
2019 op één na warmste jaar ooit Hoe anders is temperatuur en thermische energie anders?
Hoe anders is temperatuur en thermische energie anders?  Nieuwe methode maakt bio-ethanol uit afval in bestaande installaties
Nieuwe methode maakt bio-ethanol uit afval in bestaande installaties Japanse astronomen ontdekken gasreuzen in een baan om geëvolueerde sterren
Japanse astronomen ontdekken gasreuzen in een baan om geëvolueerde sterren
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

