
Wetenschap
Waarom geen waterige oplossing van natriumchloride gebruikt in plaats daarvan gesmolten?
* Water is bij voorkeur geëlektolyseerd: Wanneer u elektriciteit aanbrengt op een waterige oplossing van natriumchloride, zijn watermoleculen gemakkelijker geëlektolyseerd dan de chloride -ionen. Dit leidt tot de vorming van waterstofgas bij de kathode en zuurstofgas bij de anode, in plaats van natrium en chloor.
* veiligheidsproblemen: Elektrolyzing water in een waterige oplossing van natriumchloride produceert waterstof- en chloorgassen. Waterstof is ontvlambaar en chloor is giftig, waardoor dit proces zeer gevaarlijk is.
Waarom wordt in plaats daarvan gesmolten natriumchloride gebruikt:
* Geen waterinterferentie: Door het gebruik van gesmolten natriumchloride (NaCl), elimineert u water uit het systeem, waardoor het wordt geëlektolyseerd. Hierdoor kunnen de chloride -ionen worden geëlektolyseerd, waardoor chloorgas bij de anode wordt geëlekteerd.
* Direct metaalproductie: De natriumionen worden ook verminderd bij de kathode, waardoor vloeibaar natriummetaal wordt geproduceerd.
Samenvattend: Het gebruik van gesmolten natriumchloride voor elektrolyse zorgt voor:
* Directe productie van natriummetaal en chloorgas.
* Veiligheid vanwege de afwezigheid van ontvlambare en giftige gassen.
Dit proces staat bekend als het downs -proces , en het is de primaire industriële methode voor het produceren van natriummetaal.
 Het gemakkelijker maken om kooldioxide af te vangen in de cementindustrie
Het gemakkelijker maken om kooldioxide af te vangen in de cementindustrie Hoe komt cardon -dioxide in de sfeer?
Hoe komt cardon -dioxide in de sfeer?  HEY Wat is de formule van deze composities:a) 4-(1,2-dimetilpropil)-2,3-dimetiloctanob) 4,6-dimetil-4-nonen-2-inoc) 4-metil-2-pentenald) 1 ,3-difenil-2-propenonae) ácido 3-hidroxi-4-oxopentanoicoUW ANTWOORD ZAL ME ECHT HELPEN:)?
HEY Wat is de formule van deze composities:a) 4-(1,2-dimetilpropil)-2,3-dimetiloctanob) 4,6-dimetil-4-nonen-2-inoc) 4-metil-2-pentenald) 1 ,3-difenil-2-propenonae) ácido 3-hidroxi-4-oxopentanoicoUW ANTWOORD ZAL ME ECHT HELPEN:)?  Het combineren van elektronenmicroscopie en simulaties om een grondig begrip te krijgen van een ijzer- en aluminiumlegering
Het combineren van elektronenmicroscopie en simulaties om een grondig begrip te krijgen van een ijzer- en aluminiumlegering  Waterzuiveringssysteem gemaakt van hout, met hulp van een magnetron
Waterzuiveringssysteem gemaakt van hout, met hulp van een magnetron
Hoofdlijnen
- In welk type cel is kern gevonden?
- Stuctuur van een celmembraan
- Zijn menselijke celled of multi -celled?
- Team ontwikkelt nieuw type antistollingsmiddel waarvan de werking snel kan worden gestopt
- Factoren die de groei van micro-organismen beïnvloeden
- Hoe noem je Symbiotic Ralation Ship tussen schimmels en blauwe groene algen?
- Hoe schimmel te identificeren in petrischalen
- Waarom dieren hun eigen geslacht het hof maken
- Is de griep eukaryotisch of prokaryotisch?
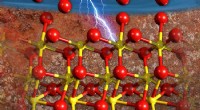
- Atomen herschikken in elektrolyt en regelen de ionenstroom onder zware omstandigheden
- Freeze frame:onderzoekers lossen op hoe cellen eiwitten ontvouwen
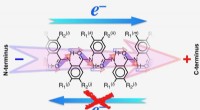
- Elektronen zetten één stap vooruit zonder twee stappen terug
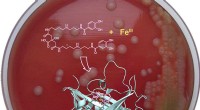
- Onderzoekers rapporteren strategie om te voorkomen dat de miltvuurbacterie ijzer absorbeert
- Spectrale metingen van ROSINA brengen de chemie van kometen tot leven

 De natuurlijke verdedigers van de aarde herstellen
De natuurlijke verdedigers van de aarde herstellen Google stelt 2 april sluitingsdatum vast voor Google+, download uw foto's en inhoud voor die tijd
Google stelt 2 april sluitingsdatum vast voor Google+, download uw foto's en inhoud voor die tijd Vijftig jaar lang hebben massale opsluitingen Amerikaanse gezinnen geschaad. Hier ziet u hoe u dit kunt wijzigen
Vijftig jaar lang hebben massale opsluitingen Amerikaanse gezinnen geschaad. Hier ziet u hoe u dit kunt wijzigen  Hoe toekomstige gevechtssystemen zullen werken
Hoe toekomstige gevechtssystemen zullen werken  Wat is een gesmolten rots?
Wat is een gesmolten rots?  Hoe een zeer 'sociaal' eiwit aanwijzingen kan bevatten over de oorsprong van Alzheimer
Hoe een zeer 'sociaal' eiwit aanwijzingen kan bevatten over de oorsprong van Alzheimer  Wat zijn niet -voorbeelden van zonne -energie?
Wat zijn niet -voorbeelden van zonne -energie?  Uitgelegd:waarom veel onderzoeken naar verre sterrenstelsels 90 procent van hun doelen missen
Uitgelegd:waarom veel onderzoeken naar verre sterrenstelsels 90 procent van hun doelen missen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

