
Wetenschap
In welke vorm treden er normaal gesproken elementen zoals waterstof voor?
* Diatomaire moleculen: Dit is de meest voorkomende vorm voor waterstof. Het bestaat als een molecuul met twee waterstofatomen aan elkaar gebonden, geschreven als h 2 .
* verbindingen: Waterstof is zeer reactief en combineert gemakkelijk met andere elementen om verschillende verbindingen te vormen. Voorbeelden zijn water (h 2 O), methaan (ch 4 ) en ammoniak (NH 3 ).
* ionen: Waterstof kan ook bestaan als een positief geladen ion (H
+
), vaak een proton genoemd. Deze vorm is cruciaal in veel chemische reacties en biologische processen.
Hoewel waterstofatomen onafhankelijk kunnen bestaan in specifieke situaties zoals plasma's of energierijke omgevingen, zijn ze over het algemeen van korte duur en reageren ze snel om moleculen of verbindingen te vormen.
Hoofdlijnen
- Een leider in de Amerikaanse zeewierteelt predikt, onderwijst en bouwt een breder netwerk op
- Waarom zijn amfibieën verstoken van schalen?
- Kattenbakvulling een eetbaar product?
- Gebruiken biologen stambomen om een cladogram te maken?
- Welke 3 dingen vormen het endomembraantransportsysteem in een cel?
- Hoe geslachtscellen de juiste genetische mix krijgen:een interdisciplinaire aanpak lost een eeuwenoude puzzel op
- Welke twee orgaansystemen werken samen als de nieren water uit bloed filteren?
- Zomerfruit is afhankelijk van bestuivers, maar waar zijn alle bijen gebleven?
- Hoe blinde grotvissen hun weg banen in het donker
- Neutronen observeren vitamine B6-afhankelijke enzymactiviteit die nuttig is voor de ontwikkeling van geneesmiddelen
- Grafeenmembranen kunnen nucleaire industrie groener maken

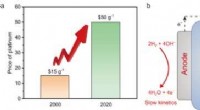
- Goedkope legering concurreert met duur platina om brandstofcellen te stimuleren
- Nieuwe MOF is potentiële next-gen halfgeleider
- De oceanen ontdoen van plastic door het afval om te zetten in waardevolle brandstof

 Snellere detectie van door fotokatalysatoren gegenereerde zuurstof heeft grote gevolgen voor schone energie
Snellere detectie van door fotokatalysatoren gegenereerde zuurstof heeft grote gevolgen voor schone energie De hightech start-up die online extremisme aanpakt
De hightech start-up die online extremisme aanpakt Dieren in het mangrove-ecosysteem
Dieren in het mangrove-ecosysteem  Waarom wanneer een planeet rond de zon draait, is het versnelling maar verandert de snelheid niet?
Waarom wanneer een planeet rond de zon draait, is het versnelling maar verandert de snelheid niet?  Lijst met genotypes
Lijst met genotypes  Hoe je een nucleaire klok laat tikken
Hoe je een nucleaire klok laat tikken  Hoe hebben Descartes en Kepler bijgedragen aan het nieuwe wetenschappelijke denken?
Hoe hebben Descartes en Kepler bijgedragen aan het nieuwe wetenschappelijke denken?  Experts onthullen grote gaten in internationaal ozonverdrag
Experts onthullen grote gaten in internationaal ozonverdrag
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


