
Wetenschap
Wat is het verschil tussen een stikstofatoom N en ion N3?
stikstofatoom (n):
* opladen: Neutraal (geen lading)
* Elektronenconfiguratie: 1S² 2S² 2p³
* Aantal elektronen: 7 (gelijk aan het aantal protonen)
* Aantal protonen: 7
* Aantal neutronen: 7 (in de meest voorkomende isotoop)
stikstofion (n³⁻):
* opladen: -3 (drie negatieve ladingen)
* Elektronenconfiguratie: 1S² 2S² 2P⁶
* Aantal elektronen: 10 (3 meer dan het aantal protonen)
* Aantal protonen: 7
* Aantal neutronen: 7 (in de meest voorkomende isotoop)
Belangrijkste verschillen:
* opladen: Het stikstofatoom is neutraal, terwijl het stikstofion een lading van -3 heeft.
* Elektronenconfiguratie: Het stikstofatoom heeft 5 valentie -elektronen in zijn buitenste schaal (2p). Het stikstofion, door drie elektronen te winnen, vult zijn 2P -schaal en bereikt een stabiele octetconfiguratie.
* Aantal elektronen: Het stikstofion heeft nog drie elektronen dan het stikstofatoom.
Vorming van n³⁻:
Stikstofatomen kunnen drie elektronen krijgen om een nitride -ion te vormen (n³⁻). Dit proces wordt reductie genoemd , terwijl het stikstofatoom elektronen krijgt. Dit resulteert in een stabiel ion met een compleet octet van elektronen in de buitenste schaal.
Samenvattend:
Het stikstofatoom is een neutrale soort met 5 valentie -elektronen, terwijl het nitride -ion (n³⁻) een negatief geladen soort is met een complete octetconfiguratie die wordt bereikt door drie elektronen te winnen.
 Insect dat wordt aangetrokken tot de bloeiende witte bloem van de nacht?
Insect dat wordt aangetrokken tot de bloeiende witte bloem van de nacht?  Welke van de huidige dieren leefden naast dinosaurussen?
Welke van de huidige dieren leefden naast dinosaurussen?  De beweging om natuurlijke hulpbronnen te beschermen?
De beweging om natuurlijke hulpbronnen te beschermen?  Wetenschappers ontdekken hoe bosbranden de vorming van regenwolken in het Amazonegebied beïnvloeden
Wetenschappers ontdekken hoe bosbranden de vorming van regenwolken in het Amazonegebied beïnvloeden  Waarom zijn planten afhankelijk van de bodem?
Waarom zijn planten afhankelijk van de bodem?
Hoofdlijnen
- Hoe kan mutatie in een gen de eigenschappen beïnvloeden die een organisme heeft?
- Het wordt het interne proces genoemd dat voedsel absorbeerbaar maakt?
- Welke ziekten worden veroorzaakt door microbe?
- Welke organismen die niet hun eigen voedsel kunnen maken, zijn?
- Een amoeba bestaat uit een enkele cel en heeft kern. Hoe heet je?
- Wat is het lot van buiskern in pollenbuis?
- Wat zijn de belangrijkste methoden en concepten in de xenobiologie?
- Wat betekent orgel in de biologie?
- Een systematische review van drie belangrijke suikermetabolisme-eiwitten:HXK, SnRK1 en TOR
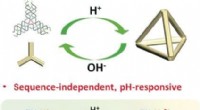
- Universele pH-gereguleerde assemblage van DNA-nanostructuren
- Nieuwe aanpak voor fotosynthetische productie van koolstofneutrale biobrandstof uit groene algen

- Onderzoekers ontwerpen nieuwe moleculen die de brandstofefficiëntie verhogen

- Algen als microscopisch kleine bioraffinaderijen
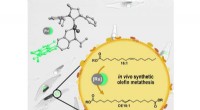
- Nieuwe methode biedt stabieler, efficiënte elektrokatalytische reacties
 Welke structuren worden aangetroffen in dierlijke cellen, maar niet in plantencellen?
Welke structuren worden aangetroffen in dierlijke cellen, maar niet in plantencellen?  Quantum race versnelt ontwikkeling van silicium-quantumchip
Quantum race versnelt ontwikkeling van silicium-quantumchip Wetenschappers bestuderen atmosferische golven die uit orkanen komen
Wetenschappers bestuderen atmosferische golven die uit orkanen komen Zuid-Azië wordt geconfronteerd met een verhoogde dubbele dreiging van extreme hitte, extreme vervuiling
Zuid-Azië wordt geconfronteerd met een verhoogde dubbele dreiging van extreme hitte, extreme vervuiling Welke planeet wordt beschouwd als de tweeling van Neptunus?
Welke planeet wordt beschouwd als de tweeling van Neptunus?  Welke grotformatie wordt gevormd langs de wanden van waar water stroomt en calciet afgezet?
Welke grotformatie wordt gevormd langs de wanden van waar water stroomt en calciet afgezet?  15 meter lang skelet van uitgestorven dolfijn suggereert parallelle evolutie onder walvissen
15 meter lang skelet van uitgestorven dolfijn suggereert parallelle evolutie onder walvissen Klimaatonderzoek moet veranderen om gemeenschappen te helpen plannen voor de toekomst
Klimaatonderzoek moet veranderen om gemeenschappen te helpen plannen voor de toekomst
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

