
Wetenschap
Een gas oefent een druk uit van 0,892 atm in 5,00 L container bij 15 graden Celsius de dichtheid is 1,22 GL Welk molecuulgewichtgas?
1. Converteer de temperatuur naar Kelvin:
* T (k) =t (° C) + 273.15
* T (k) =15 ° C + 273.15 =288,15 k
2. Gebruik de ideale gaswet:
* Pv =nrt
* P =druk (atm) =0,892 atm
* V =volume (l) =5,00 l
* n =aantal mol
* R =ideale gasconstante (0,0821 l · atm/mol · k)
* T =temperatuur (k) =288,15 k
3. Oplossen voor het aantal mol (n):
* n =(pv) / (rt)
* n =(0,892 atm * 5,00 l) / (0,0821 l · atm / mol · k * 288.15 k)
* n ≈ 0,199 mol
4. Bereken de massa van het gas:
* Dichtheid =massa / volume
* Massa =dichtheid * volume
* Massa =1,22 g/l * 5,00 l =6,10 g
5. Bepaal het molecuulgewicht:
* Molecuulgewicht (m) =massa / mol
* M =6,10 g / 0,199 mol
* M ≈ 30.7 g/mol
Daarom is het molecuulgewicht van het gas ongeveer 30,7 g/mol.
 Wat is de formule van hydride gevormd door zwavel?
Wat is de formule van hydride gevormd door zwavel?  Hoeveel elektronen heeft chloor nodig om een volledige buitenste schaal te hebben?
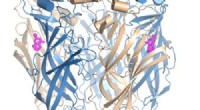
Hoeveel elektronen heeft chloor nodig om een volledige buitenste schaal te hebben?  Moleculair fossiel:De kristalstructuur laat zien hoe RNA, een van de oudste katalysatoren in de biologie, wordt gemaakt
Moleculair fossiel:De kristalstructuur laat zien hoe RNA, een van de oudste katalysatoren in de biologie, wordt gemaakt  Heks hiervan is geen monatomisch element F Kr Rn Ne?
Heks hiervan is geen monatomisch element F Kr Rn Ne?  Welke chemische familie is niet reactief?
Welke chemische familie is niet reactief?
 Vulkaanuitbarstingen op hoge breedte hebben wereldwijde impact
Vulkaanuitbarstingen op hoge breedte hebben wereldwijde impact De beste plaatsen om te Stargaze
De beste plaatsen om te Stargaze  We hebben meer dan genoeg calorieën, maar hoe zit het met andere voedingsstoffen?
We hebben meer dan genoeg calorieën, maar hoe zit het met andere voedingsstoffen? Bosbranden in Zuid-Afrika zullen toenemen:hoe juridische stappen het land kunnen helpen zich beter aan te passen aan de klimaatverandering
Bosbranden in Zuid-Afrika zullen toenemen:hoe juridische stappen het land kunnen helpen zich beter aan te passen aan de klimaatverandering  Een veldstudie van hoe een individu zijn of haar omgeving en samenleving bekijkt?
Een veldstudie van hoe een individu zijn of haar omgeving en samenleving bekijkt?
Hoofdlijnen
- Een exemplaarcollectie helpt een wetenschapper onderzoek te doen?
- Waarom kan een cel veel rRNA maken, maar slechts één kopie van het DNA?
- Wat zijn de functies van de twaalfvingerige darm?
- Wat biedt ATP?
- Waarom zebravissen beschadigd hartweefsel kunnen regenereren, terwijl andere vissoorten dat niet kunnen
- Wat is het verschil tussen actief en passief cellulair transport?
- Bio-ethicus bespreekt vier sleutels om te weten over mogelijkheden, valkuilen van genbewerking
- Wat is het buitenste deel van het vrouwelijke voortplantingssysteem?
- Weten hoe cellen groeien en delen kan leiden tot robuustere productieve planten
- Nieuw biomateriaal kan plastic laminaten vervangen, sterk verminderen vervuiling

- Objecten printen die levende organismen kunnen bevatten

- Een kankervernietigersubstantie met nieuw werkingsmechanisme gevonden

- Chemici ontdekken een nieuw vormingsmechanisme van stoffen tegen kanker
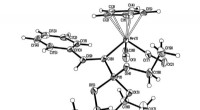
- Nieuwe moleculaire ontwerpen ontsluiten het therapeutisch potentieel van nicotinereceptoren
 Dikke afzettingen van wind opgeblazen fijne korrelige sedimenten?
Dikke afzettingen van wind opgeblazen fijne korrelige sedimenten?  Brengt Singapore daglichtspaartijden in acht?
Brengt Singapore daglichtspaartijden in acht?  Mozilla-initiatief helpt spraaktechnologiespelers via meertalige dataset
Mozilla-initiatief helpt spraaktechnologiespelers via meertalige dataset Japanse AI-tool voorspelt wanneer rekruten hun baan zullen opzeggen
Japanse AI-tool voorspelt wanneer rekruten hun baan zullen opzeggen  Australië gaat ingrijpende cyberwetten aannemen, ondanks angsten van techgiganten
Australië gaat ingrijpende cyberwetten aannemen, ondanks angsten van techgiganten Hoe knopen van positie kunnen wisselen op een DNA-streng
Hoe knopen van positie kunnen wisselen op een DNA-streng  Wat is de vergelijking voor reactie met gas in lucht?
Wat is de vergelijking voor reactie met gas in lucht?  Hoe weet ik dat mijn zon-, maan- en horizon -borden?
Hoe weet ik dat mijn zon-, maan- en horizon -borden?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

