
Wetenschap
Wat is de polariteit van tert-butylchloride?
* Elektronegativiteitsverschil: Chloor is aanzienlijk elektronegatief dan koolstof. Dit betekent dat chloor de gedeelde elektronen in de C-CL-binding sterker aantrekt, waardoor een gedeeltelijke negatieve lading (δ-) op het chlooratoom en een gedeeltelijke positieve lading (δ+) op het koolstofatoom ontstaat.
* Moleculaire geometrie: Het koolstofatoom in tert-butylchloride is bevestigd aan vier groepen:drie methylgroepen en het chlooratoom. Dit resulteert in een tetraëdrische geometrie rond de koolstof, wat leidt tot een ongelijke verdeling van elektronendichtheid.
Over het algemeen dragen de polaire C-Cl-binding en de asymmetrische moleculaire geometrie bij aan de polaire aard van Tert-butylchloride.
 Hoeveel neutronen zitten er in een normaal uraniumatoom?
Hoeveel neutronen zitten er in een normaal uraniumatoom?  Wordt in een verbrandingsreactie koolstof gebruikt om reactanten te laten branden?
Wordt in een verbrandingsreactie koolstof gebruikt om reactanten te laten branden?  Nieuwe katalysator maakt weg vrij voor koolstofneutrale brandstof
Nieuwe katalysator maakt weg vrij voor koolstofneutrale brandstof Nieuwe ontwikkelingen voor het verminderen van defecten in multimaterialen met behulp van gerichte energiedepositie
Nieuwe ontwikkelingen voor het verminderen van defecten in multimaterialen met behulp van gerichte energiedepositie Hoeveel mol waterstof is er nodig om 36 gram water te maken?
Hoeveel mol waterstof is er nodig om 36 gram water te maken?
 Groot buitenonderzoek toont aan dat biodiversiteit de stabiliteit van algenbiobrandstofsystemen verbetert
Groot buitenonderzoek toont aan dat biodiversiteit de stabiliteit van algenbiobrandstofsystemen verbetert Maak een lijst van alle niet -levende wezens in woestijn?
Maak een lijst van alle niet -levende wezens in woestijn?  Natuurrampeffecten
Natuurrampeffecten Hoe stadslandbouw de voedselzekerheid in Amerikaanse steden kan verbeteren
Hoe stadslandbouw de voedselzekerheid in Amerikaanse steden kan verbeteren Mannen gered na slechte GPS-informatie op weg naar Yellowstone
Mannen gered na slechte GPS-informatie op weg naar Yellowstone
Hoofdlijnen
- Wat is een niet -voorbeeld van chromosoom?
- Wat zijn de mechanismen achter de verdrijving van zoöxanthella uit koraal?
- Hoe worden bacteriën resistent tegen antibiotica?
- Wat is wereldwijde hypokinese?
- Organisme: definitie, types, kenmerken en voorbeelden
- The Bioteque:een computertool om biologische kennis te harmoniseren
- Hoe reageert het immuunsysteem op veranderde zwaartekracht?
- Welke uitspraken beschrijven Theocritus correct?
- Gasachtige koeien zijn slecht voor de planeet; Kan een zeewierdieet helpen?
- Automatisch en flexibel spaakwielen produceren uit composietmaterialen

- Studie zet vraagtekens bij de rol van loodvergiftiging bij sterfgevallen door Franklin Expedition

- Brug over gekoppelde wateren:wetenschappers 3D-printen volledig vloeibaar laboratorium op een chip
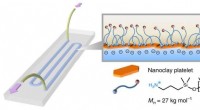
- Een manier om de absolute stereochemie van kleine, organische moleculen
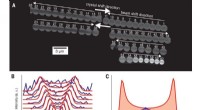
- Ingenieurs kunnen ultrazeldzame eiwitten in bloed detecteren met behulp van een mobiele camera

 Wat is de chemische formule van waterstofbroom van waterige oplossing?
Wat is de chemische formule van waterstofbroom van waterige oplossing?  Welke soorten straling zijn er in de ruimte?
Welke soorten straling zijn er in de ruimte?  Japan bestraft verschillende cryptocurrency-uitwisselingen na hack
Japan bestraft verschillende cryptocurrency-uitwisselingen na hack Waarom zou ijzer op een magneet worden gebruikt in plaats van staal?
Waarom zou ijzer op een magneet worden gebruikt in plaats van staal?  Edmunds vergelijkt de Honda CR-V en Toyota RAV4
Edmunds vergelijkt de Honda CR-V en Toyota RAV4 NASA-satelliet vindt tropische storm Wipha over de Golf van Tonkin
NASA-satelliet vindt tropische storm Wipha over de Golf van Tonkin Heliumkristallen van hoge kwaliteit vertonen supersolid-gedrag
Heliumkristallen van hoge kwaliteit vertonen supersolid-gedrag  Hoe gastheercelenzymen het coronavirus bestrijden
Hoe gastheercelenzymen het coronavirus bestrijden
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

