
Wetenschap
Hoe verschillen de smelt- en kookpunten van water van die een suikerwateroplossing?
smeltpunt:
* Puur water: Het smeltpunt van zuiver water is 0 ° C (32 ° F) .
* Suiker-wateroplossing: Het smeltpunt van een suikerwateroplossing is lager dan die van puur water. Dit komt omdat de opgeloste suikermoleculen de waterstofbruggen tussen watermoleculen verstoren, waardoor het voor de oplossing iets gemakkelijker wordt om van een vaste naar een vloeibare toestand over te gaan. De exacte vriespuntdepressie hangt af van de concentratie van suiker.
kookpunt:
* Puur water: Het kookpunt van zuiver water is 100 ° C (212 ° F) bij standaard atmosferische druk.
* Suiker-wateroplossing: Het kookpunt van een suikerwateroplossing is hoger dan die van puur water. Dit komt door een fenomeen genaamd kookpunthoogte. De opgeloste suikermoleculen creëren een hogere concentratie van opgeloste deeltjes, die meer energie vereisen om de intermoleculaire krachten te overwinnen en over te gaan naar een gasvormige toestand. Hoe hoger de concentratie van suiker, hoe hoger het hoogtepunt van het kookpunt.
Sleutelpunten:
* Colligatieve eigenschappen: Smeltpuntdepressie en kookpunthoogte zijn voorbeelden van colligatieve eigenschappen. Deze eigenschappen hangen uitsluitend af van het aantal opgeloste deeltjes opgelost in een oplosmiddel, niet van de aard van die deeltjes.
* concentratie is belangrijk: De mate waarin het smeltpunt wordt ingedrukt en het kookpunt is verhoogd, hangt af van de concentratie van de suikeroplossing. Meer geconcentreerde oplossingen ervaren een grotere verandering in deze eigenschappen.
Laat het me weten als je een meer gedetailleerde uitleg van een specifiek aspect wilt!
 Wat is de gebalanceerde netto ionische vergelijking voor reactie van waterige calciumhydroxide met fosforzuur?
Wat is de gebalanceerde netto ionische vergelijking voor reactie van waterige calciumhydroxide met fosforzuur?  Is base een stof die zich combineert met H-plus-ionen wanneer opgelost in water?
Is base een stof die zich combineert met H-plus-ionen wanneer opgelost in water?  Wat gebeurt er met een vloeistof als deze wordt verwarmd?
Wat gebeurt er met een vloeistof als deze wordt verwarmd?  Ingenieurs vinden dat antioxidanten de visualisatie van polymeren op nanoschaal verbeteren
Ingenieurs vinden dat antioxidanten de visualisatie van polymeren op nanoschaal verbeteren Wat is de functie van suiker in een mengsel?
Wat is de functie van suiker in een mengsel?
Hoofdlijnen
- Welke medische is wetenschap?
- Hoe LEGO DNA-modellen te maken
- Welk deel van de gastheer eten bacteriën en virussen?
- Verschil tussen Homozygoot en Heterozygoot
- Hoe schimmels hebben bijgedragen aan het ontstaan van het leven zoals wij dat kennen
- Waarom wetenschappers Alfred Wegener geloven?
- Wat is de naam van wetenschapper die evolutie bestudeerde?
- Wat is metrologhy de wetenschap van?
- Kunnen de vocalisaties van chimpansees de oorsprong van de menselijke taal onthullen?
- Wetenschappers brengen polymeren in focus op atomaire schaal

- Ultrasnelle waterstofbrugdynamiek van vloeibaar water onthuld door THz-geïnduceerd Kerr-effect
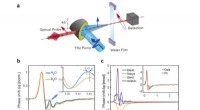
- Een nieuw materiaal voor transparante en flexibele displays

- Oorsprong van het leven:chemische evolutie in een kleine Golfstroom

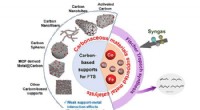
- Op koolstof gebaseerde katalysatoren die worden gebruikt voor Fischer-Tropsch-synthese
 Casimirkracht die wordt gebruikt om objecten te besturen en te manipuleren
Casimirkracht die wordt gebruikt om objecten te besturen en te manipuleren Wat is Sir Isaac Newtons 1 wet?
Wat is Sir Isaac Newtons 1 wet?  Taiwan legt waterrantsoenering op naarmate de droogte verergert
Taiwan legt waterrantsoenering op naarmate de droogte verergert Is de Noordpool alleen een magnetische pool van de aarde?
Is de Noordpool alleen een magnetische pool van de aarde?  Dit enzym stelde het leven in staat een vijandige aarde te veroveren
Dit enzym stelde het leven in staat een vijandige aarde te veroveren Wat is een aparte kracht?
Wat is een aparte kracht?  Op welke kleur van een ster hangt van?
Op welke kleur van een ster hangt van?  Hoeveel pi-binding in so2?
Hoeveel pi-binding in so2?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

