
Wetenschap
Leg uit waarom destillatie een goede manier is om C8H18- en C5H12 -vloeistoffen te scheiden?
Dit is waarom:
* Kookpuntverschil: Octaan heeft een hoger kookpunt (125,7 ° C) vergeleken met pentaan (36,1 ° C). Dit verschil in kookpunten is aanzienlijk, waardoor ze gemakkelijk worden gescheiden door destillatie.
* Distillatieproces: In destillatie wordt het mengsel verwarmd. De component met het onderste kookpunt (pentaan) zal eerst verdampen, waardoor het hogere kookpuntcomponent (octaan) achterblijft.
* Dampcollectie: De pentaandamp wordt verzameld en terug in vloeibare vorm, resulterend in een zuiver pentaanmonster. De resterende vloeistof in de destillatiekolf is voornamelijk octaan.
Hier is een vereenvoudigde uitsplitsing:
1. Verwarming: Het mengsel van octaan en pentaan wordt verwarmd.
2. verdamping: Pentane, met zijn onderste kookpunt, verdampt eerst.
3. Condensatie: De pentaandamp wordt afgekoeld en terug in vloeibare vorm, waardoor deze van het octaan wordt gescheiden.
4. Collectie: De pure pentaanvloeistof wordt afzonderlijk verzameld.
5. resterend octaan: De vloeistof die overblijft in de destillatiekolf is voornamelijk octaan.
Daarom maakt het significante verschil in kookpunten tussen octaan en pentaan een efficiënte scheiding mogelijk met behulp van destillatie.
 Invasieve tropische plant kan metaalverontreinigende stoffen volledig uit de Britse rivieren verwijderen - nieuwe studie
Invasieve tropische plant kan metaalverontreinigende stoffen volledig uit de Britse rivieren verwijderen - nieuwe studie Wat betekent schadelijk in de wetenschapsterm?
Wat betekent schadelijk in de wetenschapsterm?  Wat is een verklaring die gebeurtenissen in de natuur beschrijft?
Wat is een verklaring die gebeurtenissen in de natuur beschrijft?  Watchdog dringt er bij China op aan de invoer van illegaal hout aan banden te leggen
Watchdog dringt er bij China op aan de invoer van illegaal hout aan banden te leggen Overstromingsschade Canada neemt toe, maar zware regenval neemt af
Overstromingsschade Canada neemt toe, maar zware regenval neemt af
Hoofdlijnen
- Wat is de functie van een bacteriecapsule?
- Welk deel van de cel dat dubbele membraan vormt de grens tussen nucleaire inhoud en cytoplasma?
- Beschrijf hoe diercellen kunnen worden getransformeerd door direct DNA te injecteren?
- Onderscheid u van de kudde:hoe koeien communiceren gedurende hun leven
- Wat is de functie van een Grasshopper -testis?
- Enkele cellen organismen met lange zweepachtige staarten?
- Genoom van flespompoen geeft inzicht in evolutionaire geschiedenis, relaties van komkommerachtigen
- Het is niet eenvoudig om individuele chromosomen tijdens interfase te observeren omdat?
- Welke communicerende resultaten van een onderzoek laten andere wetenschappers toe?
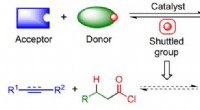
- Voorlopers van zuurchloride maken met behulp van shuttle-katalyse
- 3D-geprinte koralen kunnen bio-energie verbeteren en koraalriffen helpen
- Voor fotokatalysatoren, de tand des tijds doorstaan betekent een perfecte partner vinden

- Waarom drinkwater moet worden gecontroleerd op hiv-medicijnen

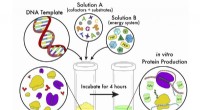
- Vereenvoudigde methode maakt celvrije eiwitsynthese flexibeler en toegankelijker
 Wat hebben plantkunde en zoölogie gemeen?
Wat hebben plantkunde en zoölogie gemeen?  Fotosynthese-geïnspireerd proces maakt basischemicaliën
Fotosynthese-geïnspireerd proces maakt basischemicaliën Wetenschappers tonen aan dat processen in het zonnestelsel de koolstofcyclus in de geschiedenis van de aarde beheersen
Wetenschappers tonen aan dat processen in het zonnestelsel de koolstofcyclus in de geschiedenis van de aarde beheersen Wat zijn de belangrijkste sterren in Pegasus?
Wat zijn de belangrijkste sterren in Pegasus?  De bubbel afbreken:micromodellen herdefiniëren hoe bubbels de CO2-gasstroom karakteriseren
De bubbel afbreken:micromodellen herdefiniëren hoe bubbels de CO2-gasstroom karakteriseren  Waarom is polair water zoutiger dan ander oceaanwater?
Waarom is polair water zoutiger dan ander oceaanwater?  Musk biedt aan om een Twitter-uitkoopdeal te sluiten tegen de oorspronkelijke prijs
Musk biedt aan om een Twitter-uitkoopdeal te sluiten tegen de oorspronkelijke prijs Supramoleculaire complexvorming - antraceen macrocyclus en C60 fullereen
Supramoleculaire complexvorming - antraceen macrocyclus en C60 fullereen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

