
Wetenschap
Wat houdt atomen bij elkaar in moleculen?
1. Covalente bindingen:
* delen van elektronen: In een covalente binding delen atomen elektronen om een stabiele elektronenconfiguratie te bereiken (zoals die van een edelgas).
* Sterke bindingen: Covalente bindingen zijn over het algemeen sterk, wat resulteert in stabiele moleculen.
* Voorbeeld: Water (H₂o) heeft twee covalente bindingen tussen het zuurstofatoom en elk waterstofatoom.
2. Ionische bindingen:
* overdracht van elektronen: Het ene atoom geeft een of meer elektronen op aan een ander atoom, wat resulteert in een positief geladen ion (kation) en een negatief geladen ion (anion).
* Elektrostatische aantrekkingskracht: De tegengesteld geladen ionen worden vervolgens tot elkaar aangetrokken en vormen een ionische binding.
* Sterke bindingen: Ionische bindingen zijn over het algemeen sterk, vooral in vaste stoffen, maar zwakker in oplossingen.
* Voorbeeld: Tafelzout (NaCl) wordt gevormd door een ionische binding tussen natrium (Na+) en chloride (Cl-) ionen.
Andere factoren die de sterkte van chemische bindingen beïnvloeden:
* elektronegativiteit: De elektronegativiteit van de atomen die betrokken zijn bij een binding beïnvloedt de sterkte ervan.
* Bondlengte: Kortere bindingslengtes duiden in het algemeen sterkere bindingen aan.
* Meerdere bindingen: Dubbele en drievoudige bindingen zijn sterker dan enkele bindingen.
Naast deze primaire soorten bindingen zijn er ook zwakkere interacties zoals waterstofbruggen en van der Waals krachten Dat kan een rol spelen bij het bij elkaar houden van moleculen, vooral in vloeistoffen en vaste stoffen.
 Afbeelding:Noordoost Ethiopië
Afbeelding:Noordoost Ethiopië Estuaria warmen twee keer zo snel op als oceanen en atmosfeer
Estuaria warmen twee keer zo snel op als oceanen en atmosfeer Twee koala's gered in bosbrand in Australië, lot 100s onbekend
Twee koala's gered in bosbrand in Australië, lot 100s onbekend NC-eilanden mysterieuze geboorte verschijnt op NASA-satellietbeelden
NC-eilanden mysterieuze geboorte verschijnt op NASA-satellietbeelden De grootste waarschijnlijke bron van microplastics in de kustwateren van Californië? Onze autobanden
De grootste waarschijnlijke bron van microplastics in de kustwateren van Californië? Onze autobanden
Hoofdlijnen
- Welk soort cel wordt ook een epitheelcel genoemd?
- Onderzoek naar de genetica van macroalgen werpt licht op hoe zeewier meercellig werd
- Evolutie ontmoet biochemie om beter te begrijpen hoe dopamine-receptoren werken
- Studie vindt hoe de overlevingstijd van stamcellen kan worden verlengd
- Wat doodt de kleinste uilen van Australië?
- Wat beschrijft het beste de structuur van DNA?
- Kunnen darmbacteriën die ons helpen bij het verteren van bier en brood ook ziektes bestrijden?
- Welke term definieert een gen dat bestaat uit twee verschillende allelen?
- Afbrekende koraalriffen slecht nieuws voor commerciële visserij
- 3D-grijswaarden digitaal licht printen (g-DLP) zeer functioneel gesorteerde materialen (FGM)

- Onderzoekers ontwikkelen nieuwe klasse onderwaterkleefstoffen
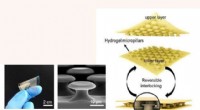
- Meegaan met de DNA-stroom:molecuul van het leven vindt nieuwe toepassingen in micro-elektronica

- Nieuwe deuren openen:eerste synthetisch mechanisch gevoelig kaliumkanaal

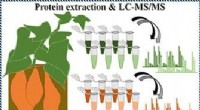
- Het proteoom van de zoete aardappel opgraven
 Belg wint eerste zonnefietsrace van Frankrijk naar China
Belg wint eerste zonnefietsrace van Frankrijk naar China Onderzoek toont aan hoe elektriciteitsetende microben elektronen gebruiken om koolstofdioxide te fixeren
Onderzoek toont aan hoe elektriciteitsetende microben elektronen gebruiken om koolstofdioxide te fixeren Wat is de overheersende windrichting in New Hampshire?
Wat is de overheersende windrichting in New Hampshire?  Op welke laag van de aarde kun je graniet vinden?
Op welke laag van de aarde kun je graniet vinden?  Het golfkarakter van licht in superslow motion
Het golfkarakter van licht in superslow motion Wat is een voorbeeld van iets dat niet-hernieuwbaar is?
Wat is een voorbeeld van iets dat niet-hernieuwbaar is?  SOFIA in Stuttgart:eerste wetenschappelijke onderzoeksvlucht boven Europa
SOFIA in Stuttgart:eerste wetenschappelijke onderzoeksvlucht boven Europa Wat is de beste definitie van het woord pathogeen?
Wat is de beste definitie van het woord pathogeen?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

