
Wetenschap
Hoe beïnvloedt de katalysator de KEQ -waarde van een reacti?
* Keq vertegenwoordigt de relatieve hoeveelheden producten en reactanten in evenwicht. Het is een thermodynamische eigenschap bepaald door het verschil in Gibbs -vrije energie tussen reactanten en producten.
* katalysatoren versnellen de snelheid van zowel de voorwaartse als de omgekeerde reacties gelijk. Ze bieden een alternatieve route met een lagere activeringsenergie, waardoor de reactie sneller het evenwicht kan bereiken.
* evenwicht is een dynamische toestand. Zelfs met een katalysator zijn de snelheden van de voorwaartse en omgekeerde reacties nog steeds gelijk in evenwicht, wat betekent dat de relatieve hoeveelheden producten en reactanten hetzelfde blijven.
Samenvattend:
* Katalysatoren beïnvloeden de kinetiek (snelheid) van een reactie, maar niet de thermodynamica (evenwichtspositie).
* Keq blijft ongewijzigd in aanwezigheid van een katalysator.
Voorbeeld:
Stel je een reactie voor waarbij de voorwaartse reactie erg traag is en de omgekeerde reactie erg snel is. Dit zou resulteren in een lage KEQ, wat aangeeft dat de reactanten de voorkeur geven aan evenwicht. Een katalysator zou zowel de voorwaartse als omgekeerde reacties versnellen, maar de relatieve snelheden zouden nog steeds hetzelfde zijn. De evenwichtspositie (en dus KEQ) zou niet veranderen, alleen de tijd die nodig is om het evenwicht te bereiken zou worden ingekort.
 Nieuwe strategie voorgesteld voor directe synthese van alcoholen door reductieve hydroformylering van alkenen
Nieuwe strategie voorgesteld voor directe synthese van alcoholen door reductieve hydroformylering van alkenen  Hoe te bepalen of een atoom polair of niet-polair is?
Hoe te bepalen of een atoom polair of niet-polair is?  Veiligheidsmaatregelen bij het gebruik van vlammen in de wetenschap
Veiligheidsmaatregelen bij het gebruik van vlammen in de wetenschap  Controle over één molecuul voor een miljoenste van een miljardste van een seconde
Controle over één molecuul voor een miljoenste van een miljardste van een seconde Waarom is het kookpunt van kalium hoger dan het smeltpunt?
Waarom is het kookpunt van kalium hoger dan het smeltpunt?
Hoofdlijnen
- Actief transport: een overzicht van primair en secundair
- Welk proces maakt een kopie van DNA -molecuul?
- Wat is een biofilm?
- Wat zijn de vier stappen van theorie -evolutie?
- Waarom is de mitochondriën belangrijk in cellen?
- Wat is Agrobacterium gemedieerde genoverdracht?
- Teleomeren zijn onnodig in bacteriën omdat het DNA circulair is?
- Waarom zijn decomposers essentieel voor de creatie?
- Wat is een verklaring op basis van wetenschappelijke kennis?
- Op polymeer gebaseerde coatings op metalen implantaten verbeteren de integratie van bot-implantaten
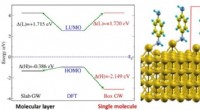
- Uitlijning van energieniveau voor moleculaire elektronica
- Naar hoogwaardige mangaanoxidekatalysatoren met grote oppervlakten

- Team haalt inspiratie uit natuurlijke wonderen om nieuwe materialen te maken

- Betere adsorptie van chemomedicijnen op gerichte toedieningscapsules

 Reizen naar de zon:waarom smelt de Parker Solar Probe niet?
Reizen naar de zon:waarom smelt de Parker Solar Probe niet? NASA kijkt naar regenval in tropische storm Harvey
NASA kijkt naar regenval in tropische storm Harvey Welke term wordt gebruikt voor moleculen met identieke moleculaire formules, maar de atomen in elk molecuul zijn anders gerangschikt?
Welke term wordt gebruikt voor moleculen met identieke moleculaire formules, maar de atomen in elk molecuul zijn anders gerangschikt?  Kantoren zijn te warm of te koud - is er een betere manier om de kamertemperatuur te regelen?
Kantoren zijn te warm of te koud - is er een betere manier om de kamertemperatuur te regelen? Mol gassen bij standaard temperatuurdruk?
Mol gassen bij standaard temperatuurdruk?  Hondenkennel ontworpen door Ford blokkeert vuurwerk, dondergeluid
Hondenkennel ontworpen door Ford blokkeert vuurwerk, dondergeluid Wat betekent gecontroleerd experiment in wetenschappelijke termen?
Wat betekent gecontroleerd experiment in wetenschappelijke termen?  Tesla sluit Model 3-assemblage weer af om knelpunten op te lossen
Tesla sluit Model 3-assemblage weer af om knelpunten op te lossen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

