
Wetenschap
Waarom Catalyst vereist wanneer waterstof reageert met jodium?
* voorwaartse reactie: H₂ (g) + i₂ (g) ⇌ 2Hi (g)
* Omgekeerde reactie: 2Hi (G) ⇌ H₂ (G) + I₂ (G)
Hoewel de reactie thermodynamisch gunstig is, wat betekent dat het energie vrijgeeft en spontaan moet verlopen, gebeurt het heel langzaam bij kamertemperatuur. Dit komt omdat de reactie een hoge activeringsenergie vereist, wat de minimale energie is die nodig is om de moleculen te botsen en hun bindingen te verbreken om nieuwe te vormen.
Een katalysator is vereist om de reactie te versnellen door de activeringsenergie te verlagen. Katalysatoren bieden een alternatieve route voor de reactie, waarbij een andere set tussenliggende stappen met lagere activeringsenergie betrokken zijn. Hierdoor kan de reactie sneller gebeuren, zelfs bij kamertemperatuur.
Hier is hoe een katalysator werkt in deze specifieke reactie:
1. Adsorptie: De reactanten (H₂ en I₂) adsorberen op het oppervlak van de katalysator.
2. verzwakking van bindingen: De katalysator verzwakt de bindingen in de reactant -moleculen, waardoor ze meer kans hebben om te breken.
3. Vorming van tussenproducten: De katalysator vergemakkelijkt de vorming van tussenliggende soorten, zoals atomaire waterstof en jodium, op het oppervlak.
4. Reactie: De tussenliggende soorten reageren met elkaar om HI te vormen.
5. desorptie: De HI Moleculen Desorb van het katalysatoroppervlak, waardoor de katalysator opnieuw kan worden gebruikt.
Gemeenschappelijke katalysatoren die in deze reactie worden gebruikt:
* platina (pt): Een zeer effectieve katalysator die vaak wordt gebruikt in laboratoriumomgevingen.
* nikkel (ni): Een minder dure katalysator die wordt gebruikt in industriële toepassingen.
Door de activeringsenergie te verlagen, versnelt de katalysator de reactie aanzienlijk, waardoor de productie van waterstofjodide met een redelijke snelheid mogelijk is.
 Wat houdt een paradigmaverschuiving in? Het paringssysteem van een olijfstruik als case study van de theorie van Kuhn
Wat houdt een paradigmaverschuiving in? Het paringssysteem van een olijfstruik als case study van de theorie van Kuhn  Luchthaven Denvers heropent na krachtige winterstorm (update)
Luchthaven Denvers heropent na krachtige winterstorm (update) Eta geselt Nicaragua met regen, dodelijke modderstromen
Eta geselt Nicaragua met regen, dodelijke modderstromen Hoe menselijke urine de bodemgezondheid en waterkwaliteit kan verstoren
Hoe menselijke urine de bodemgezondheid en waterkwaliteit kan verstoren  Magnitude vergelijking onderscheidt kleine aardbevingen van explosies in het westen van de VS
Magnitude vergelijking onderscheidt kleine aardbevingen van explosies in het westen van de VS
Hoofdlijnen
- Wat stelt de bacteriën in staat om transfergenen samen te voegen?
- Een gedenatureerd eiwit kan zich opnieuw vormen naar zijn functionele vorm wanneer het in de normale omgeving wordt teruggebracht. Wat betekent dat voor een bevestiging?
- Wat is de opening in het ene neuron communiceert met een ander dat bekend staat als wat?
- Wat betreft het fuseren van een cel zonder kern van een volwassen organisme met een ander organisme?
- Waarom groeit de wortel eerst?
- Onderzoekers onthullen hoe acetylering de centromeerdynamiek, chromosoomsegregatie en mitotische progressie reguleert
- Wat is de langste fase van de celcyclus?
- Hebben dieren- en plantencellen kernen een vacuolen?
- Wanneer een oudercel meerdere kernen maakt en zich verdeelt om dochtercellen te maken, wordt deze genoemd?
- Robotchemicus ontdekt nieuwe moleculen en reacties

- In kaart brengen van het energietransportmechanisme van chalcogenideperovskiet voor gebruik van zonne-energie
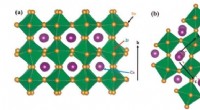
- Nieuwe nikkelkatalysator werkt in water om broeikasgas om te zetten in chemische grondstof
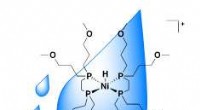
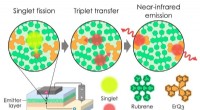
- Excitonlimieten zijn bedoeld om te worden overschreden:OLED overtreft 100 procent excitonproductie-efficiëntie
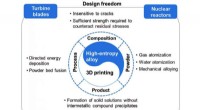
- Onderzoekers beoordelen de vooruitgang in 3D-printen van legeringen met hoge entropie
 Wat zijn de celdelen voor organellen?
Wat zijn de celdelen voor organellen?  Waarom was het wetenschappelijke werk van Galileo en Descartes cintraversieel?
Waarom was het wetenschappelijke werk van Galileo en Descartes cintraversieel?  Milieuadvocaat roept op tot een gendergevoelig internationaal juridisch raamwerk om klimaatmigranten te beschermen
Milieuadvocaat roept op tot een gendergevoelig internationaal juridisch raamwerk om klimaatmigranten te beschermen  Zonlicht krakende rotsen op Bennu
Zonlicht krakende rotsen op Bennu Astronauten knijpen in laatste ruimtewandeling voor vertrek SpaceX
Astronauten knijpen in laatste ruimtewandeling voor vertrek SpaceX Feiten over baby wolven
Feiten over baby wolven  Wat is het doel van een transformator?
Wat is het doel van een transformator?  Wat gebeurt er met CA2 React CO2?
Wat gebeurt er met CA2 React CO2?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

