
Wetenschap
Waarom gedraagt ammoniak NH3 zich zodra een basis reageert met een zuur?
1. Alleen elektronen: Ammoniak heeft een eenzaam paar elektronen op het stikstofatoom. Dit enige paar is direct beschikbaar om een proton te accepteren, waardoor Ammoniak een Lewis -basis is.
2. Vorming van ammoniumion: Wanneer ammoniak reageert met een zuur, accepteert het eenzame paar op het stikstofatoom een proton van het zuur, waardoor het ammoniumion wordt gevormd (NH4+). Deze reactie is een evenwichtsreactie:
NH3+ H+ ⇌ NH4+
3. Brønsted-Lowry Definitie: Volgens de Brønsted-Lowry-definitie van zuren en basen is een basis een stof die een proton accepteert. Ammoniak past in deze definitie omdat het gemakkelijk een proton van een zuur accepteert, waardoor het ammoniumion wordt gevormd.
Voorbeeld:
Wanneer ammoniak reageert met zoutzuur (HCL), treedt de volgende reactie op:
NH3 + HCl ⇌ NH4 + + Cl-
In deze reactie accepteert ammoniak een proton van HCl, waardoor het ammoniumion (NH4+) en chloride-ion (Cl-) wordt gevormd. Deze reactie is een klassiek voorbeeld van ammoniak die als basis fungeert.
Conclusie:
Het vermogen van Ammoniak om een proton te accepteren vanwege de enige elektronen, maakt het een basis volgens zowel de Definities van Lewis als Brønsted. De reactie ervan met zuren resulteert in de vorming van het ammoniumion, een klassiek kenmerk van een basis die reageert met een zuur.
 Wat is het totale aantal atomen in 14,5 g natriumacetaat?
Wat is het totale aantal atomen in 14,5 g natriumacetaat?  Waarom is concentratie belangrijk in een chemische reactie?
Waarom is concentratie belangrijk in een chemische reactie?  Instrument kan mail-in-testen mogelijk maken om zware metalen in water te detecteren
Instrument kan mail-in-testen mogelijk maken om zware metalen in water te detecteren Welk proces waar chemie betrokken is bij het besturen van een auto?
Welk proces waar chemie betrokken is bij het besturen van een auto?  Wat zijn de drie soorten niet -metalen ophanging?
Wat zijn de drie soorten niet -metalen ophanging?
 Team biedt eerste blik op hoe vleermuizen landen (met video)
Team biedt eerste blik op hoe vleermuizen landen (met video)  Toen de ijstijd eindigde, was het land bedekt meestal?
Toen de ijstijd eindigde, was het land bedekt meestal?  Activisten gebruiken schokkende beelden op sociale media om actie te stimuleren in de strijd tegen plasticvervuiling
Activisten gebruiken schokkende beelden op sociale media om actie te stimuleren in de strijd tegen plasticvervuiling Biochemische cycli die materialen tussen landlucht en water verplaatsen beïnvloeden welke drie gebieden van de aarde?
Biochemische cycli die materialen tussen landlucht en water verplaatsen beïnvloeden welke drie gebieden van de aarde?  Het effect van alcohol op planten
Het effect van alcohol op planten
Hoofdlijnen
- Welk systeem regelt de ademhaling?
- Wat zijn de vergelijkbare kenmerken die hun oorsprong vinden in een gedeelde voorouder?
- Waarom moet je wetenschap studeren?
- Welke cellen van organismen geven energie af van voedsel?
- Hoe zouden een organisme en zijn cellen worden geholpen door een warme temperatuur?
- Wat is het nuttige micro -organisme dat aanwezig is in wrongel?
- Een methode met wortels in AI legt bloot hoe mensen keuzes maken in groepen en sociale media
- Vooruitgang op weg naar een biologische brandstofcel?
- Welke menselijke activiteiten zijn er in het westen van Cordillera?
- Kunstmatige enzymfuncties evenals natuurlijke versie
- Het nabootsen van het falen om de sterkte in composieten te vinden

- Titaandioxide-sterren in onderzoek bij synchrotron in Krakau

- Computerkatalysatoren - team ontsluit de moleculaire geheimen van een populair polymeer
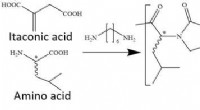
- Pepsine-afbreekbare plastics van bio-nylons van itacon en aminozuren
 Vijf kenmerken van een chemische verandering
Vijf kenmerken van een chemische verandering 3 aardbevingen schudden de grootste stad van Alaska, maar geen schademeldingen
3 aardbevingen schudden de grootste stad van Alaska, maar geen schademeldingen Welke nieuwe emoji's komen eraan?
Welke nieuwe emoji's komen eraan? Structuur van plastic zonnecellen belemmert hun efficiëntie, onderzoekers vinden
Structuur van plastic zonnecellen belemmert hun efficiëntie, onderzoekers vinden Hoe Bernoullis Theorem Experiment to Kids uit te leggen
Hoe Bernoullis Theorem Experiment to Kids uit te leggen  Wat is de rol van verdamping bij het onderhouden van het leven op aarde?
Wat is de rol van verdamping bij het onderhouden van het leven op aarde?  Berekening van afschuifspanning op bouten
Berekening van afschuifspanning op bouten Wiskunde als wapen tegen woestijnvorming
Wiskunde als wapen tegen woestijnvorming
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

