
Wetenschap
Hoe beïnvloedt het gemeenschappelijke ioneffect pH?
Hoe het gemeenschappelijke ioneneffect de pH beïnvloedt
1. verschuivende evenwicht: Beschouw een zwak zuur (ha) in oplossing:
`` `
Ha (aq) <=> h + (aq) + a- (aq)
`` `
Dit zuur ioniseert gedeeltelijk, waardoor een kleine concentratie H+ -ionen ontstaat, waardoor de oplossing zuur wordt. Stel je nu voor dat je een oplosbaar zout toevoegt dat de geconjugeerde basis A- (bijv. NAA) bevat. De toevoeging van A- verschuift het evenwicht naar links, volgens het principe van Le Chatelier.
2. Dalende [H+] en toenemende pH: De evenwichtsverschuiving zorgt ervoor dat het zwakke zuur minder ioniseert, wat resulteert in een lagere concentratie van H+ -ionen. Omdat pH omgekeerd evenredig is met [H+], zal de pH van de oplossing toenemen (minder zuur wordt).
Voorbeelden:
* Natriumacetaat (NAAC) toevoegen aan een oplossing van azijnzuur (HAC):
- NAAC lost op in Na+ en acions.
- De acties zijn veel voorkomende ionen, waardoor het evenwicht van de dissociatie van azijnzuur verschuift:
`` `
Hac (aq) <=> h + (aq) + ac- (aq)
`` `
- Het evenwicht verschuift naar links, daalt [H+] en verhoogt de pH.
* Natriumchloride (NaCl) toevoegen aan een oplossing van zoutzuur (HCL):
- HCl is een sterk zuur, volledig ioniserend in oplossing, en NaCl is een neutraal zout.
- Het toevoegen van NaCl introduceert geen gemeenschappelijk ion, dus er is geen effect op de pH.
Sleutelpunten:
* Het gemeenschappelijke ioneneffect is alleen van toepassing op zwakke zuren en basen.
* Het effect is meer uitgesproken wanneer de concentratie van het gemeenschappelijke ion significant is in vergelijking met de initiële concentratie van het zwakke zuur of base.
* Het gemeenschappelijke ioneneffect is essentieel bij het begrijpen van het gedrag van bufferoplossingen, die weerstand bieden aan veranderingen in pH.
Laat het me weten als je nog meer vragen hebt!
 Wetenschappers ontwerpen snel, omkeerbare bio-geïnspireerde katalysatoren
Wetenschappers ontwerpen snel, omkeerbare bio-geïnspireerde katalysatoren Wat is het oxidatiegetal van chloor in CIF5?
Wat is het oxidatiegetal van chloor in CIF5?  Hoeveel gram ontstaat er bij de reactie van zilvernitraat met natriumchloride uit 100 g als er een overmaat chloride aan wordt toegevoegd?
Hoeveel gram ontstaat er bij de reactie van zilvernitraat met natriumchloride uit 100 g als er een overmaat chloride aan wordt toegevoegd?  Onderzoekers ontwikkelen natuurlijk alternatief voor pesticiden om plagen aan te pakken zonder honingbijen te schaden
Onderzoekers ontwikkelen natuurlijk alternatief voor pesticiden om plagen aan te pakken zonder honingbijen te schaden Onderzoekers ontwikkelen test van 15 minuten om immuunrespons te beoordelen
Onderzoekers ontwikkelen test van 15 minuten om immuunrespons te beoordelen
Hoofdlijnen
- Hebben dieren en planten DNA?
- Phototroph (Prokaryote Metabolism): Wat is het?
- Welke celstructuur bevat het grootste deel van het genetische materiaal?
- Welk celgedeelte bepaalt welke moleculen in of uit de cel gaan?
- Waarom komt evolutie voor door de overerving van verworven kenmerken?
- Wat is het doel van chromosomen?
- Wat is basofiele degeneratie?
- Nieuwe studie werpt licht op hoe X- en Y-chromosomen op elkaar inwerken
- Waar komen de allelen voor een eigenschap in een zygote vandaan?
- Goedkope hernieuwbare energie:het fotosyntheseproces doorbreken dat planten in staat stelt om wat te splitsen

- Onderzoek onthult nieuw mechanisme achter epilepsie en medicijnmodulatie
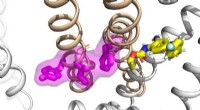
- Chemici ID katalytische sleutel voor het omzetten van CO2 in methanol
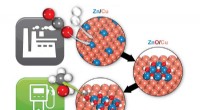
- Wetenschappers suggereren een milieuvriendelijke manier om zeer actieve katalysatoren te verkrijgen

- Onderzoekers maken een magneet gemaakt van één molecuul
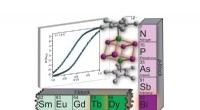
 Observatoria werken samen om zeldzame dubbele asteroïde te onthullen
Observatoria werken samen om zeldzame dubbele asteroïde te onthullen Zijn er speciale kenmerken van de korst?
Zijn er speciale kenmerken van de korst?  Wat zijn de belangrijkste chemische elementen die worden aangetroffen in cellen in de biologie?
Wat zijn de belangrijkste chemische elementen die worden aangetroffen in cellen in de biologie?  Wat is de luchtvochtigheid van de Mojave-woestijn?
Wat is de luchtvochtigheid van de Mojave-woestijn?  Video:Een tegengif voor dodelijke paddenstoelen?
Video:Een tegengif voor dodelijke paddenstoelen?  Wat is de hardheid van andesietgesteente?
Wat is de hardheid van andesietgesteente?  Leonardo da Vinci's nemen dynamisch vliegen over
Leonardo da Vinci's nemen dynamisch vliegen over Wat is de totale lading van elektronen in een natriumion?
Wat is de totale lading van elektronen in een natriumion?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

